Reakcja Blaise'a
| Reakcja Blaise'a | |
|---|---|
| Nazwany po | Edmonda E. Blaise'a |
| Typ reakcji | Reakcja sprzęgania |
| Identyfikatory | |
| Portal Chemii Organicznej | |
| Identyfikator ontologii RSC | |
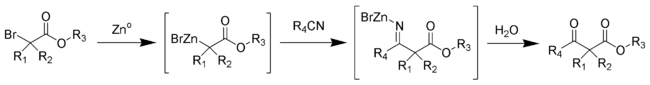
Reakcja Blaise'a jest reakcją organiczną , która tworzy β-ketoester w reakcji metalicznego cynku z α-bromoestrem i nitrylem . Reakcja została po raz pierwszy opisana przez Edmonda Blaise'a (1872–1939) w 1901 r. Końcowym związkiem pośrednim jest metaloimina, która jest następnie hydrolizowana z wytworzeniem pożądanego β-ketoestru.
Masywne estry alifatyczne mają tendencję do dawania wyższych wydajności. Steven Hannick i Yoshito Kishi opracowali ulepszoną procedurę.
Zauważono, że w przebiegu tej reakcji mogą być tolerowane wolne grupy hydroksylowe, co jest zaskakujące w przypadku reakcji halogenków metaloorganicznych.
Mechanizm
Mechanizm reakcji Blaise'a obejmuje tworzenie kompleksu cynkoorganicznego z bromem alfa do estru karbonylowego. To sprawia, że węgiel alfa jest nukleofilowy, co pozwala mu atakować elektrofilowy węgiel nitrylu. Ujemny azot nitrylowy powstały w wyniku tego ataku tworzy kompleksy z kationem monobromku cynku. w postaci β-enaminoestru (tautomeru iminowego związku pośredniego pokazanego powyżej) ujawnia się po obróbce 50% K2CO3aq . Jeśli pożądanym produktem jest β-ketoester, dodanie 1 M kwasu chlorowodorowego hydrolizuje β-enaminoester, przekształcając enamino w keton, tworząc β-ketoester.
Zobacz też
- Bibliografia _ Komp. Rozdzierać. 1901 , 132 , 478.
- ^ Rinehart, KL, Jr. Organic Syntheses , Coll. Tom. 4, str. 120 (1963); Tom. 35, str. 15 (1955). ( artykuł )
- Bibliografia _ Rafi S.; Padmavathy, K. Tetrahedron 2008 , 64 , 8037-8043. (Recenzja)
- Bibliografia _ Rinehart, KL, Jr.; Thorston, SD, Jr. J. Org. chemia 1953 , 18 , 1594. ( doi : 10.1021/jo50017a022 )
- Bibliografia _ Kishi, Y. J.Org. chemia 1983 , 48 , 3833. ( doi : 10.1021/jo00169a053 )
- Marko, IE J. Am. chemia soc. 2007 , JAK NAJSZYBCIEJ doi : 10.1021/ja0691728
- Wang, D.; Yue, J.-M. Synlett 2005 , 2077-2079.