Reakcja Baylisa-Hillmana
| Reakcja (Morita –) Baylisa – Hillmana | |
|---|---|
| Nazwany po |
Ken-ichi Morita Anthony B. Baylis Melville ED Hillman |
| Typ reakcji | Reakcja sprzęgania |
| Identyfikatory | |
| Portal Chemii Organicznej | |
| Identyfikator ontologii RSC | |
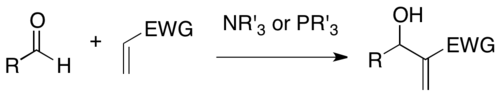
Baylisa -Hillmana to reakcja tworzenia wiązania węgiel-węgiel między pozycją α aktywowanego alkenu a elektrofilem węgla, takim jak aldehyd. Wykorzystując katalizator nukleofilowy, taki jak trzeciorzędowa amina i fosfina, reakcja ta dostarcza gęsto funkcjonalizowany produkt (np. funkcjonalizowany alkohol allilowy w przypadku aldehydu jako elektrofilu). Jej nazwa pochodzi od Anthony'ego B. Baylisa i Melville'a ED Hillmana, dwóch chemików, którzy opracowali tę reakcję podczas pracy w Celanese . Ta reakcja jest również znana jako reakcja Mority – Baylisa – Hillmana lub reakcja MBH , ponieważ K. Morita opublikował wcześniejsze prace na jej temat.
DABCO jest jednym z najczęściej stosowanych katalizatorów amin trzeciorzędowych w tej reakcji. Ponadto stwierdzono , że aminy nukleofilowe , takie jak DMAP i DBU , a także fosfiny , skutecznie katalizują tę reakcję.
Reakcja MBH ma kilka zalet jako użyteczna metoda syntezy: 1) Jest atomowo-ekonomicznym sprzężeniem łatwo przygotowanych materiałów wyjściowych. 2) Reakcja prochiralnego elektrofilu generuje centrum chiralne, dzięki czemu możliwa jest synteza asymetryczna. 3) Produkty reakcji zwykle zawierają wiele grup funkcyjnych w pobliżu, tak że możliwe są różnorodne dalsze przekształcenia. 4) Może wykorzystywać nukleofilowy układ katalityczny bez użycia metali ciężkich w łagodnych warunkach.
Napisano kilka recenzji.
Mechanizm reakcji
Hoffmann jako pierwszy zaproponował mechanizm reakcji MBH. Pierwszy etap reakcji obejmuje 1,4-addycję katalitycznej aminy trzeciorzędowej do aktywowanego alkenu w celu wytworzenia obojnaczego aza-enolanu. W drugim etapie ten enolan dodaje się do aldehydu poprzez dodanie aldolu. Trzeci etap obejmuje wewnątrzcząsteczkowe przesunięcie protonów, które następnie generuje końcowy addukt MBH i uwalnia katalizator poprzez eliminację E2 lub E1cb w ostatnim etapie. Hill i Isaacs przeprowadzili eksperymenty kinetyczne, aby zbadać szczegóły mechanistyczne. Szybkość reakcji między akrylonitrylem i aldehydem octowym była pierwszego rzędu w stężeniach akrylonitrylu, aldehydu octowego i DABCO. Hill i Isaacs zaproponowali, że etap dodawania aldolu, który obejmuje wszystkie trzy reagenty, jest zatem etapem determinującym szybkość. To, że nie zaobserwowali kinetycznego efektu izotopowego przy użyciu α-deutrylowanego akrylonitrylu, również potwierdziło to stwierdzenie.
Jednak ta początkowa mechanistyczna propozycja była krytykowana z kilku powodów. Szybkość reakcji MBH została przyspieszona przez nagromadzenie produktu (efekt autokatalityczny), którego mechanizm nie mógł zracjonalizować. Nie spodziewano się również powstawania znacznych ilości „niezwykłego” dioksanonu jako produktu ubocznego w reakcji MBH aldehydów arylowych z akrylanami.
McQuade i in. oraz Aggarwal i in. dokonali ponownej oceny mechanizmu MBH przy użyciu zarówno kinetyki, jak i badań teoretycznych, koncentrując się na etapie przeniesienia protonu. Według McQuade'a reakcja MBH między akrylanem metylu a p-nitrobenzaldehydem jest drugiego rzędu w stosunku do aldehydu i wykazuje znaczący kinetyczny efekt izotopowy w pozycji α akrylanu (5,2 w DMSO). Niezależnie od rozpuszczalników stwierdzono, że KIE jest większe niż 2, co wskazuje na znaczenie abstrakcji protonów w etapie określania szybkości. Na podstawie tych nowych danych McQuade zaproponował nowy mechanizm, sugerując, że etapem przeniesienia protonu jest RDS. Pierwszy i drugi etap nie ulegają zmianie, ale po pierwszym dodaniu aldolu następuje drugie dodanie aldehydu, z wytworzeniem alkoholanu hemiacetalu. Następnie decydujący o szybkości etap przeniesienia protonu poprzez sześcioczłonowy stan przejściowy uwalnia addukt A , który dalej reaguje z wytworzeniem produktu MBH B lub dioksanonu jako produktu ubocznego C. Mechanizm ten odpowiada za powstawanie produktu ubocznego dioksanonu.
Aggarwal skupił się na efekcie autokatalitycznym i zauważył, że katalityczne ilości produktu MBH lub metanolu usunęły ten efekt. Zaproponował więc, że we wczesnym stadium reakcji działa mechanizm katalizowany bezalkoholowo, równoważny propozycji McQuade'a, natomiast po 20% konwersji dominuje mechanizm katalizowany alkoholem. Na tym późniejszym etapie alkohol R'OH wspomaga etap przeniesienia protonu określający szybkość poprzez sześcioczłonowy stan przejściowy. Aggarwal i Harvey modelowali te dwa szlaki za pomocą obliczeń teorii funkcjonału gęstości i wykazali, że obliczony profil energii dobrze pasuje do eksperymentalnego kinetycznego efektu izotopowego i obserwowanej szybkości reakcji. Wykazali również, że ogólna bariera entalpiczna szlaku katalizowanego alkoholem jest nieco mniejsza niż szlaku niekatalizowanego alkoholem, racjonalizując to, że gdy stężenie alkoholu (produkt MBH) wzrasta, szlak katalizowany alkoholem zaczyna dominować, wykazując autokataliza.
Podczas gdy badania McQuade'a i Aggarwala cieszą się ostatnio dużym zainteresowaniem, istnieje wiele kwestii, które nie zostały jeszcze rozwiązane. Po pierwsze, propozycja McQuade'a dotycząca roli pośredniego A nie została jasno udowodniona. Ponieważ A można utworzyć po prostu przez dodanie B do aldehydu, tworzenie A i C może zachodzić poza mechanizmem MBH. McQuade twierdzi, że etap określający szybkość obejmuje dwie cząsteczki aldehydu, ponieważ szybkość reakcji w aldehydzie jest drugiego rzędu, ale nie wyjaśnia, dlaczego Hill i Isaac zaobserwowali pierwszy rząd dla swoich substratów. Rzeczywiście, ogromna zmienność substratów dla reakcji MBH jest ograniczeniem dla badania ogólnego mechanizmu reakcji MBH w ujednolicony sposób. Ponadto Aggarwal wcześniej zasugerował, że RDS reakcji zmienia się z przeniesienia protonu na dodanie aldolu w trakcie reakcji, opierając się na fakcie, że efekt pierwotnego izotopu kinetycznego zanika po 20% konwersji, ale późniejsze badania obliczeniowe wykazały, że etap przeniesienia protonu nadal ma najwyższą barierę w późnym stadium reakcji. Rozbieżność między wynikami kinetycznymi i obliczeniowymi sugeruje, że nadal istnieją mechanistyczne aspekty reakcji MBH, które nie są dobrze poznane.
Ostatnio Coelho i Eberlin et al. wykorzystali dane ESI-MS do dostarczenia danych eksperymentalnych potwierdzających dualistyczną naturę etapu przeniesienia protonu w reakcji, dając w ten sposób pierwszy dowód strukturalny na mechanistyczne propozycje McQuade'a i Aggarwala dla tego etapu RDS reakcji.
Implikacje dotyczące katalizy asymetrycznej
Niemniej jednak model Aggarwala rzucił światło na asymetryczną katalizę reakcji MBH. Sugeruje to, że wszystkie cztery diastereoizomery pośredniego alkoholanu powstają w reakcji, ale tylko jeden ma donor wiązań wodorowych odpowiednio umieszczony, aby umożliwić szybki transfer protonów, podczas gdy inne diastereoizomery powracają do materiałów wyjściowych. Te mechanistyczne badania skierowały uwagę na zdolność katalizatora do donorowania protonów (kwas Bronsteda). Jeśli kwas Bronsteda lub zasada Lewisa mogłyby być odpowiednio umieszczone na chiralnej cząsteczce, zasada Lewisa reagowałaby z substratem (dodatek Michaela), podczas gdy kwas w środowisku asymetrycznym umożliwiałby chiralny transfer protonu. Kwas Bronsteda pozostaje związany wiązaniami wodorowymi z powstałym enolanem w etapie addycji enolanu do aldehydu i ostatecznie zapewnia wydajny transfer protonów w etapie abstrakcji protonów determinującym szybkość. Działanie kokatalizatorów Bronsteda, które są często stosowane w reakcji MBH, nie ogranicza się do roli w etapie przeniesienia protonu. Raczej promuje dodawanie koniugatu poprzez wiązanie z enolanem obojnaczym i stabilizowanie tych związków pośrednich.
Zakres
Ponieważ dwoma składnikami reakcji MBH są ogólnie aktywowany alken i elektrofil, można wygenerować ogromną liczbę kombinacji partnerów reakcji. Zwłaszcza reakcja aza-Baylisa-Hillmana jest ważnym wariantem reakcji MBH z wykorzystaniem imin jako elektrofilów. Chociaż w większości przypadków jako elektrofile stosuje się aldehydy, ketony lub iminy, udokumentowano kilka doniesień o zastosowaniu halogenków allilu, halogenków alkilu i epoksydów.
Addukty Baylisa-Hillmana i ich pochodne były szeroko wykorzystywane do generowania heterocykli i innych cyklicznych struktur szkieletowych.
Użycie allenu zamiast prostego alkenu jako prekursora daje związek pośredni, który może reagować na węglu gamma , a nie na alfa.
Ograniczenia
Ponieważ istnieje duża zmienność substratów reakcji, często trudno jest opracować warunki reakcji odpowiednie dla określonej kombinacji substratów. Na przykład β-podstawione aktywowane olefiny, sulfony winylowe i sulfotlenki winylu wykazują niską reaktywność, spowalniając lub zapobiegając reakcji. Konkurencyjne reakcje funkcyjności substratów są również problematyczne. Akroleiny są podatne na oligomeryzację, a alleniany łatwo ulegają reakcjom cykloaddycji. Niezwykle trudno jest opracować odpowiednie warunki do stosowania halogenków alkilowych i epoksydów jako elektrofilów.
Pomimo szerokiego zakresu, ekonomii atomowej i powszechności reakcji, powolna szybkość reakcji Baylisa-Hillmana (czas reakcji wynoszący dwa tygodnie lub nawet dłużej nie jest rzadkością, nawet przy 25 do 100% molowych katalizatora) dla aldehydów alifatycznych z zawadą przestrzenną i bogate w elektrony benzaldehydy często ograniczają syntetyczną użyteczność procesu. Na przykład, w przypadku t- butylu z zawadą przestrzenną, reakcja z benzaldehydem z DABCO jako katalizatorem pod nieobecność rozpuszczalnika wymaga 4 tygodni, aby uzyskać umiarkowane poziomy konwersji do pożądanego produktu. W obecności rozpuszczalników aprotonowych szybkość reakcji jest jeszcze mniejsza, chociaż dodatki protonowe (np. alkohole i kwasy karboksylowe) mogą przyspieszać reakcję. Ketony na ogół nie są wystarczająco reaktywne, aby brać udział w reakcji w sposób syntetycznie użyteczny w zwykłych warunkach. Jednak ze względu na bardzo ujemną objętość aktywacji, powolne reakcje Baylisa-Hillmana, w tym te, w których jako substraty stosuje się ketony, można przeprowadzić prowadząc reakcję pod wysokim ciśnieniem (do 20 kbar).
Problemem może być również wysoka reaktywność aktywowanego alkenu. Reakcja MBH ketonu arylowo-winylowego z aldehydem nie jest prosta, ponieważ reaktywny keton arylowo-winylowy łatwo łączy się najpierw z inną cząsteczką ketonu arylowo-winylowego poprzez addycję Michaela, a następnie addukt dodaje się do aldehydu, tworząc podwójny addukt MBH.
Nadal brakuje również ogólnego rozwiązania asymetrycznej reakcji MBH różnych substratów. Ogólnie rzecz biorąc, reakcja MBH nie jest jeszcze na dojrzałym etapie i wciąż jest dużo miejsca na rozwój potężnych i ogólnych systemów katalitycznych.
Warianty
Reakcja Sila-MBH
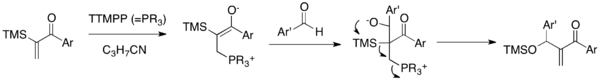
Reakcja Sila-MBH jest wariantem MBH, który łączy α-sililowane winyloaryloketony z aldehydami w obecności katalitycznego TTMPP (Schemat 5). Enolan obojniaczojonowy, wytworzony po dodaniu katalizatora nukleofilowego do enonu, uległby addycji do grupy karbonylowej aldehydu w celu wytworzenia alkoholanu. Ten alkoholan przechodzi kolejne przegrupowanie 1,3-Broka i kaskadę eliminacji z wytworzeniem siloksymetylenenonu i uwolnieniem katalizatora. Ta reakcja pozwala na syntezę syloksy-metylenoaryloenonów, klasy, która była niedostępna w tradycyjnej reakcji MBH. Co ważne, ta reakcja przezwycięża problem podwójnego dodawania MBH ketonów arylowo-winylowych.
Reakcja Rauhuta-Curriera
Reakcja Rauhuta-Curriera jest reakcją aktywowanego alkenu i akceptora Michaela, a nie aldehydu czy iminy. Nazywa się to również winylogiczną reakcją MBH. Ponieważ reakcja Rauhuta-Curriera często łączy dwa aktywowane alkeny, występowały problemy z selektywnością. Ze względu na lepszą reaktywność i selektywność zastosowano wewnątrzcząsteczkową reakcję Rauhuta-Curriera. Na przykład cyklizację Rauhuta-Curriera α,β-nienasyconych aldehydów można przeprowadzić w obecności pochodnej proliny i kwasu octowego, uzyskując produkty wzbogacone enancjomerycznie.
Reakcja tandemowa / Wieloskładnikowa reakcja w jednym naczyniu
reakcji wieloskładnikowych jest atrakcyjna ze względu na swoją atomowo-ekonomiczną zaletę. Reakcję MBH można zastosować do trójskładnikowego sprzęgania aldehydów, amin i aktywowanych alkenów z wytworzeniem adduktów aza-MBH. Na przykład, reakcje aldehydów arylowych, difenylofosfinoamidu i ketonu metylowo-winylowego w obecności TiCl4 , trifenylofosfiny i trietyloaminy dają odpowiednie addukty aza-MBH.
Ponadto aktywowane acetyleny można dodawać do elektrofilów po dodaniu Michaela . Jodek trimetylosililu jako donor Michaela może prowadzić reakcję trójskładnikową, podczas gdy cyklizacja tandemowa jest również możliwa poprzez atak Michaela na ugrupowanie w elektrofilu MBH.
Asymetryczna reakcja MBH
Pomocnik chiralny
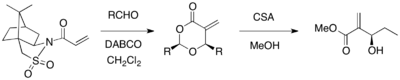
Sultam Oppolzera może być użyty jako chiralny środek pomocniczy w asymetrycznej reakcji MBH. Gdy akrylan podstawiony sultamem Oppolzera reagował z różnymi aldehydami w obecności katalizatora DABCO, otrzymano optycznie czyste 1,3-dioksan-4-ony z odszczepieniem substancji pomocniczej (wydajność 67-98%, >99% ee). Produkty cykliczne można przekształcić w pożądane produkty MBH przy użyciu CSA i metanolu.
Pokrewny hydrazydowy środek pomocniczy można również zastosować w podobnej reakcji MBH katalizowanej przez DABCO. Chiralny akryloilohydrazyd może reagować diastereoselektywnie z aldehydami. Oba diastereoizomery można było otrzymać z tych samych reagentów przez inny dobór rozpuszczalników (DMSO dało jeden diastereoizomer, podczas gdy THF/H2O dał drugi), co sugeruje, że konformacja struktury przejściowej zależy od rozpuszczalnika.
Chiralne alleny i iminy można zastosować w asymetrycznej reakcji aza-MBH katalizowanej przez DABCO. Optycznie aktywny buta-2,3-dienian 10-fenylosulfonyloizobornylu reaguje z aryloiminą dając α-allenyloaminę w sposób diastereoselektywny (wydajność 37-57%).
Chiralny katalizator oparty na zasadzie Lewisa
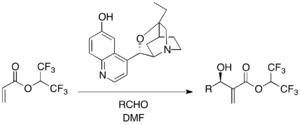
Chiralne trzeciorzędowe katalizatory aminowe są stosowane w enancjoselektywnych reakcjach MBH. β-ICD, pochodna alkaloidu chinowego, jest znana wśród katalizatorów opartych na chinidynie. Akrylan 1,1,1,3,3,3-heksafluoroizopropylu jako aktywowany alken i różne aldehydy ulegają reakcji MBH w obecności β-ICD. Wykazano, że tlen fenolowy z β-ICD jest ważny w reakcji, co sugeruje funkcję ugrupowania kwasowego Bronsteda. β-ICD i jego pokrewne wersje są skutecznymi katalizatorami dla różnych innych substratów.
Cyklopentenon i różne aromatyczne i alifatyczne aldehydy przechodzą asymetryczną reakcję z użyciem planarnego chiralnego katalizatora DMAP Fu w izopropanolu (54-96% wydajności, 53-98% ee). W tym przypadku do przyspieszenia reakcji potrzebny był jodek magnezu jako kokatalizator kwasu Lewisa. Zbadano P -chiralne fosfiny .
Proste diaminy można również stosować jako katalizatory MBH. Stwierdzono, że keton metylowo-winylowy i różne podstawione benzaldehydy ulegają asymetrycznej reakcji MBH. Chiralny katalizator pirolidynowy był skuteczny w przypadku orto- i para-podstawionych benzaldehydów z niedoborem elektronów (75-99% wydajności, 8-73% ee).
Chiralne katalizatory fosfinowe MBH często zawierają ugrupowanie kwasu Bronsteda w swoich szkieletach. Na przykład chiralne fosfiny zawierające zasadę Lewisa, kwas Bronsteda i aktywowaną kwasem zasadę Bronsteda opracowano do asymetrycznej reakcji aza-MBH (86-96% wydajności, 79-92% ee). Zaproponowano, aby ugrupowania kwasowe i zasadowe Bronsteda brały udział w stabilizacji form obojnaczych w sposób stereoselektywny.
Pochodzący z BINOL-u chiralny katalizator fosfinowy jest również skuteczny w asymetrycznej reakcji aza-MBH N-tosyloimin z aktywowanymi alkenami, takimi jak keton metylowo-winylowy i akrylan fenylu.
Ponadto odrębna klasa chiralnych cząsteczek fosfino- skwaroamidu może skutecznie katalizować wewnątrzcząsteczkową asymetryczną reakcję MBH. ω-formylenony przereagowały dając enancjomeryczne produkty cykliczne w temperaturze otoczenia (wydajność 64-98%, ee 88-93%).
Katalizator chiralny kwas Lewisa
Zainteresowano się chiralnymi katalizatorami kwasowymi Lewisa, ponieważ mogą one aktywować grupę odciągającą elektrony w sposób enancjoselektywny. Wykazano, że chiralne kationowe katalizatory oksazaborolidyniowe są skuteczne w trójskładnikowym sprzęganiu estrów α, β-acetylenowych, aldehydów i jodku trimetylosililu (50-99% wydajności, 62-94% ee). Oba produkty enancjomeryczne można otrzymać stosując różne enancjomery katalizatora.
Kompleks soli metalu i ligandu chiralnego jest również realną strategią. La(OTf) 3 i chiralne ligandy pochodzące z kamfory mogą indukować enancjoselektywność w katalizowanej przez DABCO reakcji MBH różnych aldehydów i akrylanów (wydajność 25-97%, ee 6-95%). W takich przypadkach zwykle stosowano wielokleszczowe ligandy do chelatowania z metalem, który aktywuje zarówno enolan obojnaczy, jak i aldehyd.
La (O-iPr) 3 i system ligandów pochodzących z BINOL-u, w połączeniu z katalitycznym DABCO, działa również w asymetrycznej reakcji aza-MBH różnych N-difenylofosfinoiloimin i akrylanu metylu. Arylowe, heteroarylowe i alkenyloiminy nadawały się do uzyskania dobrej wydajności i enancjoselektywności.
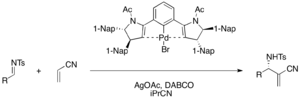
Chiralne kompleksy szczypiec palladu (II) działają jak kwas Lewisa w enancjoselektywnej katalizowanej przez DABCO reakcji aza-MBH akrylonitrylu i różnych tosyloimin, dając funkcjonalizowane α-metyleno-β-aminonitryle (wydajność 75-98%, 76-98% ee) . Octan srebra jest wymagany do aktywacji prekatalizatora bromku palladu w cyklu katalitycznym.
Chiralny kokatalizator kwasu Bronsteda
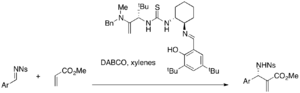
Różne chiralne katalizatory tiomocznikowe są badane pod kątem asymetrycznych reakcji MBH. Chiralne katalizatory tiomocznikowe i bis (tiomocznikowe) mogą być skuteczne w reakcjach MBH i aza-MBH katalizowanych przez DABCO. Katalizator tiomocznikowy Jacobsena przeprowadza na przykład enancjoselektywną reakcję aza-MBH (25-49% wydajności, 87-99% ee).
Podczas gdy prosty tiomocznik wymaga połączenia katalizatora nukleofilowego, katalizatory dwufunkcyjne, takie jak fosfino-tiomoczniki, można stosować samodzielnie w asymetrycznych reakcjach MBH. Na przykład różne akrylany i aldehydy aromatyczne reagują w obecności tych katalizatorów, dając albo enancjomeryczne addukty MBH (wydajność 32-96%, ee 9-77%).
Reakcja MBH może obejmować pochodną proliny jako kokatalizator. Zaproponowano, że imidazolowy katalizator nukleofilowy i prolina wpływają na reakcję poprzez iminiowy związek pośredni. Z (S)-proliną i DABCO, α-amidosulfony i α,β-nienasycone aldehydy przechodzą wysoce enancjoselektywną reakcję aza-MBH (wydajność 46-87%, E/Z 10:1-19:1, 82-99% eee).
Zastosowania w syntezie organicznej
Reakcje MBH są szeroko stosowane w syntezie organicznej. Na przykład reakcja ta została wykorzystana do skonstruowania kluczowych cyklicznych związków pośrednich do syntezy salinosporamidu A, dywersonolu i anatoksyny-a.