Nienasycony węglowodór

Węglowodory nienasycone to węglowodory , które mają podwójne lub potrójne wiązania kowalencyjne między sąsiednimi atomami węgla . Określenie „nienasycony” oznacza, że do węglowodoru można dodać więcej atomów wodoru , aby uczynić go nasyconym (tj. składającym się wyłącznie z pojedynczych wiązań). Konfiguracja węgli nienasyconych obejmuje proste łańcuchy, takie jak alkeny i alkiny , a także rozgałęzione i związki aromatyczne .
Z wyjątkiem związków aromatycznych , węglowodory nienasycone są w większości reaktywne i podlegają wielu reakcjom z ich wielokrotnymi wiązaniami.
Nomenklatura
Ze względu na przejrzystą komunikację i mniej nieporozumień konieczny jest spójny system nazewnictwa, który daje początek nomenklaturze IUPAC.
Poniżej omówiono niektóre standardowe kroki, które należy wykonać podczas nazywania cząsteczek węglowodorów nienasyconych za pomocą nomenklatury IUPAC.
- 1. Znajdź i policz liczbę atomów węgla w najdłuższym łańcuchu węglowym i użyj odpowiedniego przedrostka liczbowego. Na przykład, jeśli najdłuższy łańcuch węglowy zawiera trzy atomy węgla, użyj przedrostka „prop-”. Przedrostek liczby atomów węgla od 1 do 10 podsumowano w poniższej tabeli.
|
liczba atomów węgla w najdłuższym łańcuchu węglowym |
prefiks |
liczba atomów węgla w najdłuższym łańcuchu węglowym |
prefiks |
|---|---|---|---|
| 1 | met- | 2 | et- |
| 3 | rekwizyt- | 4 | Ale- |
| 5 | zamknięty- | 6 | klątwa- |
| 7 | hept- | 8 | październik- |
| 9 | nie- | 10 | gru- |
- 2. Określ sufiks na podstawie rodzaju węglowodoru .
- Jeśli obecne jest jedno lub więcej wiązań podwójnych, należy użyć przyrostka „ -ene ”.
- Jeśli obecne jest jedno lub więcej wiązań potrójnych, należy użyć przyrostka „ -yne ”.
- Jeśli obecne są zarówno wiązania podwójne, jak i potrójne, użyj obu przyrostków „-ene” i „-yne”. „-ene” zwykle występuje przed „-yne”, ponieważ leksykograficznie „e” poprzedza „y”.
- 3. Policzcie liczbę wiązań podwójnych lub potrójnych i wskażcie to przedrostkiem liczbowym przed „-ene” lub „-yne”. Na przykład łańcuch węglowy z 4 atomami węgla zawierający 2 podwójne wiązania będzie nazwany „ butadien ”.
- 4. Dodaj liczby pomiędzy przedrostkiem liczby atomów węgla a „-en” lub „-yn”, aby wskazać pozycję atomu węgla wyjściowego wiązań podwójnych lub potrójnych. Na przykład łańcuch węglowy z 4 atomami węgla zawierający podwójne wiązanie między drugim a trzecim atomem węgla będzie nazwany „ but-2-en ”.
- 5. Na koniec użyj przedrostka przed przedrostkiem liczby atomów węgla, aby wskazać obecne łańcuchy boczne . Prosty węglowy łańcuch boczny nazywa się po prostu przez dodanie „-yl” po przedrostku oznaczającym liczbę atomów węgla w tym łańcuchu. Na przykład, jeśli grupa etylowa jest przyłączona do drugiego atomu węgla w pent-2-enie , cząsteczka otrzyma nazwę „ 2-etylopent-2-en ”. Nazewnictwo bardziej skomplikowanych łańcuchów bocznych można znaleźć w nomenklaturze chemii organicznej IUPAC . Przedrostki łańcuchów bocznych są dodawane do końcowej nazwy leksykograficznie, co oznacza, że grupa etylowa pojawi się wcześniej niż grupa metylowa.
- Jeśli związek jest okrągły, użyj przedrostka „ cyklo- ”. Na przykład pierścień węglowy z 5 atomami węgla zawierający 1 podwójne wiązanie będzie nazwany „ cyklopenten ”.
Struktura
izomeria
W chemii organicznej przedrostki cis- i trans- są używane do opisania pozycji grup funkcyjnych przyłączonych do atomów węgla w wiązaniu podwójnym. Po łacinie cis i trans oznaczają odpowiednio „po tej stronie” i „po drugiej stronie”. Zatem, jeśli grupy funkcyjne znajdują się po tej samej stronie łańcucha węglowego, wiązanie jest przypisywane cis , w przeciwnym razie (tzn. grupy funkcyjne są po przeciwnej stronie łańcucha węglowego), wiązanie jest przypisywane konfiguracji trans .
Konfiguracja cis i trans wymaga istnienia łańcucha węglowego lub co najmniej jednej grupy funkcyjnej przyłączonej do każdego węgla jest taka sama. Konfiguracji E i Z można zamiast tego użyć w bardziej ogólnym przypadku, gdy wszystkie cztery grupy funkcyjne przyłączone do atomów węgla w wiązaniu podwójnym są różne. E- i Z- to skróty niemieckich słów zusammen (razem) i entgegen (naprzeciwko). W izomerii E i Z każda grupa funkcyjna ma przypisany priorytet w oparciu o reguły pierwszeństwa Cahna – Ingolda – Preloga . Jeśli dwie grupy o wyższym priorytecie znajdują się po tej samej stronie wiązania podwójnego, wiązanie to otrzymuje Z , w przeciwnym razie ( tj. - konfiguracja. Należy zauważyć, że konfiguracja cis i trans nie ma stałego związku z konfiguracją E i Z.
Hybrydyzacja orbitalna
Wiadomo, że węgiel ma konfigurację elektronową 1s 2 2s 2 2p 2 . Ponieważ jedynymi niesparowanymi elektronami, które ma, są dwa na orbitalach 2p, węgiel jest teoretycznie zdolny do tworzenia tylko 2 pojedynczych wiązań. Jednak zdecydowanie nie jest to prawdą, ponieważ w rzeczywistości każdy węgiel w eterze tworzy 2 wiązania pojedyncze i 1 wiązanie podwójne, podczas gdy każdy węgiel w etynie tworzy 1 wiązanie pojedyncze i 1 wiązanie potrójne. W rzeczywistości to hybrydyzacja orbitalna powoduje powstanie tego dziwnego zjawiska.
W cząsteczkach podobnych do etyny, w których węgiel tworzy 1 wiązanie potrójne i 1 wiązanie pojedyncze, atom węgla przechodzi hybrydyzację sp, co oznacza, że orbital 2s i jeden orbital 2p łączą się, tworząc dwa orbitale sp, a pozostałe dwa orbitale 2p pozostają niezmienione. Kąt między dwoma orbitalami sp wynosi 180°, a pierwszy niezmieniony orbital 2p jest prostopadły do dwóch orbitali sp, podczas gdy drugi niezmieniony orbital 2p jest prostopadły do obu orbitali sp i pierwszego niezmienionego orbitalu 2p. 4 elektrony z orbitali 2s i 2p są równo rozłożone pomiędzy dwa orbitale sp i dwa orbitale 2p (tj. jeden elektron na każdym orbicie). Podczas tworzenia wiązania jeden orbital sp z węgla tworzy pojedyncze wiązanie σ z jednym innym atomem, a jednocześnie pozostały jeden orbital sp i dwa orbitale 2p tworzą wiązanie σ oraz dwa wiązania π (wiązanie potrójne) z inny atom, co skutkuje liniową geometrią cząsteczkową.
W cząsteczkach etenopodobnych, w których węgiel tworzy 1 podwójne wiązanie i 2 pojedyncze wiązania, atom węgla przechodzi hybrydyzację sp 2 , co oznacza, że orbitale 2s i dwa orbitale 2p łączą się, tworząc trzy orbitale sp 2 , a jeden orbital 2p po lewej stronie pozostaje niezmieniony. Trzy orbitale sp 2 znajdują się w tej samej płaszczyźnie z kątem 60° między każdym z nich, a niezmieniony orbital 2p jest prostopadły do wszystkich trzech orbitali sp 2 . 4 elektrony z orbitali 2s i 2p są równo rozłożone między trzy sp 2 orbitale i niezmieniony orbital 2p (tj. jeden elektron na każdym orbicie). Podczas tworzenia wiązania dwa orbitale sp 2 z węgla tworzą dwa oddzielne pojedyncze wiązania σ odpowiednio z dwoma innymi atomami, a jednocześnie pozostały orbital sp i niezmieniony orbital 2p tworzą wiązanie σ oraz wiązanie π (a podwójne wiązanie) z innym atomem, co skutkuje trygonalną płaską geometrią cząsteczkową.
Istnieje również hybrydyzacja sp 3 , w której orbital 2s i wszystkie trzy orbitale 2p są łączone, tworząc cztery orbitale sp 3 . Węgiel z hybrydyzacją sp 3 będzie miał tetraedryczną geometrię cząsteczkową i dlatego jest nasycony.
Stopień nienasycenia
Stopień nienasycenia to obliczenie używane do pomiaru liczby wiązań π w nienasyconej cząsteczce organicznej . We wspólnym związku złożonym z węgla , wodoru , tlenu , azotu i halogenu stopień nienasycenia można wyrazić wzorem:
-
DU = 2C+NF-H+2 / 2
- C = liczba atomów węgla w związku
- N = liczba atomów azotu w związku
- F = liczba atomów halogenu w związku
- H = liczba atomów wodoru w związku
- liczba atomów tlenu lub jakichkolwiek innych atomów dwuwartościowych nie wpływa na stopień nienasycenia
Stopień nienasycenia oznacza również, że do związku można dodać co najwyżej 2 atomy wodoru DU, aby był nasycony.
Właściwości fizyczne
Temperatura wrzenia i topnienia
To jest lista przedstawiająca temperatury wrzenia i topnienia nasyconych i nienasyconych węglowodorów o tej samej liczbie atomów węgla.
| Liczba węgla | Temperatura topnienia/wrzenia ( °C ) | alkan | alken | alkiny |
|---|---|---|---|---|
| 2 | Temperatura topnienia |
etan -183 |
eten -169 |
etyn -80,7 |
| Temperatura wrzenia |
etan -89 |
eten -104 |
etyn -84,7 |
|
| 3 | Temperatura topnienia |
propan -190 |
propen -185 |
propyn -102,7 |
| Temperatura wrzenia |
propan -42 |
propen -47 |
propyn -23,2 |
|
| 4 | Temperatura topnienia |
butan -138 |
1-buten -185,3 |
1-butyn -125,7 |
| Temperatura wrzenia |
butan -0,5 |
1-buten -6,2 |
1-butyn 8,0 |
|
| 5 | Temperatura topnienia |
pentan -130 |
1-penten -165,2 |
1-pentyn -90,0 |
| Temperatura wrzenia |
pentan 36 |
1-penten 29,9 |
1-pentyne 40,1 |
Podobnie jak ich nasycone odpowiedniki, węglowodory nienasycone są zwykle niepolarne . Oznacza to, że siły międzycząsteczkowe między cząsteczkami nienasyconych węglowodorów są przeważnie słabymi siłami Van der Waalsa . Temperatura wrzenia i topnienia węglowodorów nienasyconych jest zwykle podobna, jak ich nasyconych odpowiedników o tej samej liczbie atomów węgla.
Temperatury topnienia i wrzenia węglowodorów nienasyconych w porównaniu z węglowodorami nasyconymi są określane przez dwa przeciwstawne czynniki. Z jednej strony siła siły Van der Waalsa zależy od liczby elektronów w cząsteczce. Węglowodory nienasycone mają mniej elektronów niż węglowodory nasycone, więc temperatura wrzenia i topnienia może spadać w miarę oddziaływania sił międzycząsteczkowych maleje. Z drugiej strony zdelokalizowane elektrony π obecne w nienasyconych węglowodorach ułatwiają przepływ elektronów w obrębie jednej cząsteczki, dzięki czemu łatwiej jest tworzyć tymczasowe dipole. Zatem siła Van der Waalsa może również wzrosnąć z powodu delokalizacji elektronów. Okazuje się, że alkiny są bardziej podatne na delokalizację elektronów i zwykle mają wyższe temperatury wrzenia niż alkany o tej samej liczbie atomów węgla. Alkeny są bardziej podatne na liczbę elektronów i mają niższe temperatury wrzenia niż alkany.
Temperatury wrzenia i topnienia zależą również od stereochemii. Alkeny cis , ze względu na swój kształt zakrzywiony w kształcie litery U, nie mogą układać się tak blisko siebie jak alkeny trans, więc będą miały niższe temperatury wrzenia i topnienia.
W przypadku dłuższych łańcuchów węglowodorów nienasyconych powyższe efekty nadal obowiązują. W dłuższych łańcuchach stereochemiczny efekt „zygzakowaty” węglowodorów nienasyconych staje się efektem dominującym, więc nienasycone węglowodory o długich łańcuchach mają zwykle niższe temperatury wrzenia i topnienia. Różnica temperatury topnienia między tłuszczami nasyconymi i nienasyconymi w organizmie człowieka również prowadzi do problemów zdrowotnych.
Rozpuszczalność
Węglowodory nienasycone są również niepolarne, co powoduje, że są słabo rozpuszczalne w wodzie. Łatwiej rozpuszczają się w niepolarnych rozpuszczalnikach organicznych, takich jak benzen .
Właściwości spektroskopowe
W porównaniu z węglowodorami nasyconymi , węglowodory nienasycone zawierają nie tylko wiązania C-C i C-H, ale także wiązania podwójne C=C i potrójne wiązania C≡C . W rezultacie widmo będzie zawierało również charakterystyki tych wiązań π. Podobnie jak alkany, spektroskopia węglowodorów nienasyconych nie pokaże właściwości innych grup funkcyjnych , takich jak alkohol (-OH) i kwas karboksylowy (-COOH).
Spektroskopia w podczerwieni
Rozciągnięcie wiązania C=C da pik absorpcji IR przy 1670-1600 cm -1 , podczas gdy zgięcie wiązania C=C absorbuje między 1000 a 650 cm -1 długości fali. Rozciąganie wiązania C≡C pochłania 2100-2140 cm -1 (monopodstawione) i 2190-2260 cm -1 (dipodstawione). Siła tych pików absorpcji zmienia się w zależności od miejsca i liczby podwójnych lub potrójnych wiązań.
Ze względu na zdelokalizowane elektrony π w grupach aromatycznych , ugięcie wiązania C=C w tych grupach zwykle pochłania między 1500 a 1700 cm -1 .
W średnim czasie piki absorpcji wiązań C–H i C–C , które są wspólne dla węglowodorów nasyconych, są również widoczne w widmie IR węglowodorów nienasyconych.
Spektroskopia NMR
W spektroskopii 1H NMR wodór związany z węglem sąsiadującym z wiązaniami podwójnymi da δ H 4,5–6,5 ppm . Wiązanie podwójne odsłania również wodór przyłączony do atomów węgla sąsiadujących z atomami węgla sp 2 , co daje δ H = 1,6–2. piki ppm. Grupy aromatyczne będą miały piki δ H = 6,5–8,5 ppm. Ponieważ wiązania π utworzą izomery cis / trans, izomery nienasyconych węglowodorów będą wyglądać inaczej z powodu różnych sprzężeń J efekt. Cis sąsiednie wodory będą miały stałe sprzężenia w zakresie 6–14 Hz , podczas gdy trans będą miały stałe sprzężenia 11–18 Hz.
W spektroskopii 13 C NMR, w porównaniu z węglowodorami nasyconymi, wiązania podwójne i potrójne również usuwały węgle, powodując, że mają one niskie przesunięcie pola. Wiązania podwójne C=C mają zwykle przesunięcie chemiczne około 100–170 ppm.
Właściwości chemiczne
Spalanie
Podobnie jak większość innych węglowodorów , węglowodory nienasycone mogą ulegać reakcjom spalania , w wyniku których powstaje dwutlenek węgla i woda podczas całkowitego spalania . Równanie reakcji to:
- C x H y + y+4x / 4 O 2 → y / 2 H 2 O + xCO 2
W przypadku braku tlenu spalanie zmieni się w spalanie niezupełne i powstanie tlenek węgla i węgiel .
Węglowodory nienasycone łatwiej wytwarzają produkt niepełnego spalania niż węglowodory nasycone. W rezultacie spalanie węglowodorów nienasyconych zwykle ma żółty płomień , inny niż niebieski płomień nasyconych. Wskazuje to, że spalanie węglowodorów nienasyconych będzie obejmować mechanizmy wieloetapowe, a spalanie węgla daje żółty kolor płomienia.
Ponieważ nienasycone węglowodory mają mniejszą zawartość wodoru, będą wytwarzać mniej wody i zmniejszać wilgotność płomienia , a także zmniejszać zużycie tlenu. Na przykład acetylen ( etyn ) może być używany jako paliwo.
W porównaniu z pojedynczymi wiązaniami σ C-C w nasyconych węglowodorach, nienasycone mają gęstość elektronową w wiązaniach π , które nie mają zbyt dużej gęstości elektronowej nakładającej się jako σ. W rezultacie energia chemiczna zmagazynowana w jednym wiązaniu podwójnym jest mniejsza niż w dwóch wiązaniach pojedynczych. Zatem spalanie węglowodorów nienasyconych, które rozrywa wiązania węgiel-węgiel w celu uwolnienia energii, uwalnia mniej energii niż spalanie tej samej molowości węglowodorów nasyconych o tej samej liczbie atomów węgla. Tendencja ta jest wyraźnie widoczna w zestawieniu standardowej entalpii spalania węglowodorów.
| Liczba węgla | Substancja | Typ | Formuła | H c ø (kJ/mol) |
|---|---|---|---|---|
| 2 | etan | nasycony | C 2 H 6 | −1559,7 |
| eten | nienasycone | C 2 H 4 | −1410,8 | |
| etyn | nienasycone | C 2 H 2 | −1300,8 | |
| 3 | propan | nasycony | CH 3 CH 2 CH 3 | −2219,2 |
| propen | nienasycone | CH3 CH = CH2 | −2058,1 | |
| propin | nienasycone | CH 3 C≡CH | −1938.7 | |
| 4 | butan | nasycony | CH 3 CH 2 CH 2 CH 3 | −2876,5 |
| but-1-en | nienasycone | CH 2 = CH-CH 2 CH 3 | −2716,8 | |
| ale-1-yne | nienasycone | CH≡C-CH 2 CH 3 | −2596,6 |
Addycja elektrofilowa
Wiązania podwójne lub potrójne, które muszą występować w węglowodorach nienasyconych, zapewniają dużą gęstość elektronową , dzięki czemu cząsteczki stają się idealnymi miejscami dla reakcji addycji elektrofilowej . W tego rodzaju reakcji jedno wiązanie π między atomami węgla rozpadnie się na 2 oddzielne wiązania σ między każdym atomem węgla a dodaną grupą. W mechanizmie zwykle bierze udział pośredni karbokation .

Uwodornienie
Uwodornienie to elektrofilowa addycja gazowego wodoru do nienasyconego węglowodoru. Rezultatem będzie bardziej nasycony węglowodór, ale niekoniecznie nasycony. Na przykład półuwodornienie alkinu może utworzyć alken . Niemniej jednak całkowita liczba wiązań π musi się zmniejszyć w tym procesie. Do tego procesu niezbędne jest również wiązanie węgiel-węgiel π.
Równanie reakcji uwodornienia etenu do etanu jest następujące:
- H 2 C=CH 2 + H 2 →H 3 C-CH 3
Reakcja uwodornienia zwykle wymaga katalizatorów , aby zwiększyć jej szybkość .
Całkowita liczba wodoru, który można dodać do nienasyconego węglowodoru, zależy od jego stopnia nienasycenia . Węglowodór nienasycony o wzorze C X H Y może zawierać najwyżej 2 X+2-Y atomów wodoru. To sprawi, że cząsteczka stanie się nasycona.
halogenowanie
Podobnie jak wodór, heteroliza halogenu (X 2 ) wytworzy elektrofilowy jon X + , po czym zostanie zaatakowany przez elektron na wiązaniu π . W odróżnieniu od wodoru, halogenowanie w większości innych przypadków spowoduje wytworzenie jonów halonowych jako związków pośrednich zamiast karbokationów. Kation halonowy pozostawia ograniczoną przestrzeń dla jonu X- do ataku i zmieni się tylko w trans produkt. Wynik netto halogenowania to zmniejszenie jednego wiązania π i zwiększenie dwóch wiązań węgiel-halogen σ na 2 atomach węgla.

równanie reakcji addycji bromu do etenu jest następujące:
- H 2 C=CH 2 + Br 2 →H 2 CBr−CH 2 Br (trans)
Test bromowy służy do badania nasycenia węglowodorów. Test polega na dodaniu wody bromowej do nieznanego węglowodoru; Jeśli woda bromowa odbarwi się pod wpływem węglowodoru, co jest spowodowane reakcją halogenowania, można stwierdzić, że węglowodór jest nienasycony. Jeśli nie jest odbarwiony, to jest nasycony.
Próba bromowa może być również stosowana jako wskaźnik stopnia nienasycenia węglowodorów nienasyconych. Liczba bromowa to gram bromu zdolnego do przereagowania ze 100 g produktu. Podobnie jak uwodornienie, halogenowanie bromu również zależy od liczby wiązań π. Wyższa liczba bromowa wskazuje na wyższy stopień nienasycenia.
Uwodnienie
Wiązanie π węglowodorów nienasyconych jest również gotowe do przyjęcia H + i OH − z wody. Reakcja zwykle obejmuje mocny kwas jako katalizator . To dlatego, że pierwszy etap mechanizmu hydratacji polega na deprotonowaniu wiązania π a H + z mocnego kwasu w celu utworzenia karbokationu . Wynik netto reakcji będzie alkoholem .
Równanie reakcji hydratacji etenu jest następujące:
- H2C = CH2 + H2O → H3C - CH2OH _ _ _
Wiązania π w wiązaniu potrójnym są również zdolne do uwodnienia w środowisku kwaśnym i tworzenia enoli. Jednak enol nie będzie produktem, ale półproduktem, a produktem końcowym będzie keton . Enolowy produkt pośredni przechodzi tautomeryzację i tworzy bardziej stabilny keton.
Równanie reakcji hydratacji etynu z wytworzeniem aldehydu octowego jest następujące:
- HC≡CH + H2O → H2C = CH−OH
- H 2 C=CH-OH ⇌ H 3 C-CHO
Hydrohalogenacja
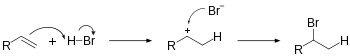
Hydrohalogenacja polega na dodaniu H-X do nienasyconych węglowodorów. Zmniejszy to jedno wiązanie π C=C i spowoduje powstanie 2 wiązań C-H i C-X σ z 2 oddzielnymi atomami węgla. Tworzenie karbokationu pośredniego jest selektywne i zgodne z regułą Markownikowa . W wyniku hydrohalogenacji alkenu powstanie haloalkan , a w wyniku hydrohalogenacji alkinu powstanie halogenek winylu . Hydrohalogenacja alkinu jest znacznie wolniejsza niż alkenu.
Równanie reakcji addycji HBr do etenu jest następujące:
- H2C = CH2 + HBr → H3C - CH2Br _
Utlenianie
Utlenianie węglowodorów nienasyconych zależy od siły środka utleniającego . Słaby utleniacz doprowadzi do dihydroksylacji , usunięcia jednego wiązania π w celu utworzenia dwóch wiązań σ z tlenem . Dihydroksylacja alkenu daje diol , a dihydroksylacja alkinu daje wicynalny dikarbonyl.
Silniejszy środek utleniający, na przykład KMnO 4 lub ozon , doprowadzi do rozszczepienia oksydacyjnego . W tym przypadku wiązanie π zrywa się z wiązaniem σ, dzieląc cząsteczkę węglowodoru na dwie części. Tlen wiąże się z pozostałymi dwoma wiązaniami π oddzielnie. Oksydacyjne rozszczepienie alkenu daje ketony lub aldehydy , w zależności od miejsca wiązania podwójnego, a rozszczepienie alkinów daje kwas karboksylowy .
Substytucja allilowa
Wiązanie π w nienasyconych węglowodorach obniży energię dysocjacji allilowych wiązań C-H, które są wiązaniami C-H węgla sąsiadującego z atomami węgla sp2 . W rezultacie podstawienia wolnych rodników będzie faworyzowana w stosunku do reakcji addycji.
Przykładem tego jest reakcja bromowania NBS z alkenem. Wiązanie N-Br w NBS jest słabe, więc powstanie dużo wolnych rodników Br. Wolny rodnik zaatakuje osłabione wodory allilowe i zastąpi je atomami bromu. Równanie reakcji to:
- RCH 2 CH=CH 2 + (CH 2 CO) 2 NBr → RCHBrCH=CH 2 + RCH=CHCH 2 Br + (CH 2 CO) 2 N
W wyniku reakcji powstaną dwa izomery z bromem przyłączonym do różnych atomów węgla. Reakcja wymaga dużej ilości wolnych rodników Br zamiast elektrofilowych jonów Br + , które przejdą reakcję addycji. NBS jest niezbędny do spełnienia takiego warunku.
Jeśli grupy węglowodorowe są przyłączone do węgla allilowego, spowoduje to, że ten węgiel będzie bardziej nasycony. Zgodnie z regułą Zajcewa , ten węgiel będzie tworzył bardziej stabilny pośredni karbokation. W rezultacie nastąpi przegrupowanie allilowe i wiązanie π przesunie się do tego węgla. Spowoduje to wytworzenie głównego produktu w postaci bromu podstawionego czterema wiązaniami węgla od grupy węglowodorowej.
Cycloaddition
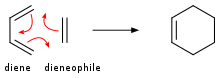
W przypadku węglowodorów nienasyconych zarówno struktura pierścienia, jak i wiązania π mogą zwiększać stopień nienasycenia, w specjalnych warunkach może zachodzić wymiana między strukturą pierścienia a wiązaniami π. Na przykład dla sprzężonego dienu i podstawionego alkenu zajdzie reakcja Dielsa-Aldera , w wyniku której powstanie cykloheksen . Taka reakcja jest wysoce selektywna w stereochemii.
Alkiny, pod katalizatorami metalowymi, na przykład kobaltem , mogą również przechodzić reakcję cykloaddycji zwaną trimeryzacją alkinów . Trzy alkiny przechodzą reakcję cyklizacji „2+2+2” i szybko łączą się, tworząc benzen . Trimeryzacja różnych alkenów zwykle nie jest selektywna, ale specjalnie zaprojektowane katalizatory mogą zwiększyć selektywność.
Reaguj jako ligand
Zdelokalizowane wiązanie π w nienasyconych węglowodorach zapewnia wysoką gęstość elektronową, dzięki czemu cząsteczka może stać się ligandem metalu . W ligandzie alkenowym strukturę wiązania można opisać modelem Dewara – Chatta – Duncansona . W tym przypadku gęstość elektronów π jest przekazywana orbitalom metalu d. Im silniejsza jest donacja, tym silniejsze jest wiązanie wsteczne z orbitalu metalu d do orbitalu antywiążącego π* alkenu. Efekt ten zmniejsza kolejność wiązań alkenu i zwiększa długość wiązania CC . W rezultacie metal tworzy małą strukturę pierścieniową z dwoma atomami węgla.
Model DCD może również opisywać strukturę liganda alkinowego . Kompleks metali może być również produktem pośrednim trimeryzacji alkinów, więc metale mogą być katalizatorami reakcji.
Syntezę kompleksów ligandów alkenowych można opisać jako reakcję addycji elektrofilowej .
Podobnie jak liniowe węglowodory nienasycone, areny mają również zdelokalizowane wiązania π, które mogą przekazywać metalom, tworząc kompleks . W przypadkach, takich jak benzen , węgle oddają jednakową gęstość elektronów metalowi, podczas gdy w niektórych innych przypadkach węgle oddają metal inaczej, powodując wygięcie areny lub odaromatyzację.
Aplikacja
Węglowodory nienasycone są szeroko stosowane jako pestycydy , paliwo , farby i wiele innych artykułów pierwszej potrzeby. Poniżej znajduje się tabela niektórych typowych handlowych węglowodorów nienasyconych.
| Nazwa | Struktura | Używać |
|---|---|---|
| eten |
|
|
| 1,3-butadien |
|
|
| benzen |
|
|
| toluen |
|
|
| naftalen |
|
Węglowodory nienasycone są również wykorzystywane w wielu reakcjach chemicznych do syntezy innych związków . Jedną z ich użyteczności w tej dziedzinie jest zastosowanie jako monomerów w reakcjach polimeryzacji . W tych reakcjach proste cząsteczki jednostek monomeru reagują i wiążą się ze sobą liniowo lub nieliniowo, tworząc makrocząsteczki, tworząc polimerowe lub struktury 3D. Podczas polimeryzacji wiązanie podwójne w monomerach zwykle zamienia się w wiązanie pojedyncze tak, że dwie inne cząsteczki monomeru mogą przyczepiać się po obu stronach. Niektóre produkty reakcji polimeryzacji są ściśle związane z naszym codziennym życiem. Na przykład jeden z powszechnych rodzajów tworzyw sztucznych, polietylen , jest produktem polimeryzacji etylenu . Również styropian (polistyren) jest syntetyzowany w wyniku polimeryzacji styrenu .