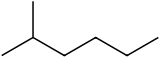
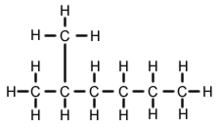
2-Metyloheksan
|
|
|
|

|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
2-Metyloheksan |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| 1696856 | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.008.847 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
| Numer RTECS |
|
| UNII | |
| Numer ONZ | 3295 |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 7 H 16 | |
| Masa cząsteczkowa | 100,205 g·mol -1 |
| Wygląd | Bezbarwna ciecz |
| Zapach | Bezwonny |
| Gęstość | 0,679 g cm -3 |
| Temperatura topnienia | -119,0 do -117,8 °C; -182,3 do -180,1 ° F; 154,1 do 155,3 K |
| Temperatura wrzenia | 89,6 do 90,6 °C; 193,2 do 195,0 ° F; 362,7 do 363,7 K |
| Ciśnienie pary | 15,7 kPa (przy 37,7 ° C) |
|
Stała prawa Henry'ego
( k H ) |
19 nmol Pa- 1 kg -1 |
| -86,24· 10-6 cm3 / mol | |
|
Współczynnik załamania światła ( n D )
|
1.384 |
| Termochemia | |
|
Pojemność cieplna ( C )
|
222,92 JK -1 mol -1 |
|
Standardowa entropia molowa ( S ⦵ 298 ) |
323,34 JK -1 mol -1 |
|
Standardowa entalpia formowania (Δ f H ⦵ 298 ) |
−231,1–228,5 kJ mol −1 |
|
Standardowa entalpia spalania (Δ c H ⦵ 298 ) |
−4,8127–−4,8103 MJ mol −1 |
| Zagrożenia | |
| Oznakowanie GHS : | |
   
|
|
| Niebezpieczeństwo | |
| H225 , H304 , H315 , H336 , H410 | |
| P210 , P261 , P273 , P301+P310 , P331 | |
| NFPA 704 (ognisty diament) | |
| Punkt zapłonu | −1 ° C (30 ° F; 272 K) |
| 280 ° C (536 ° F; 553 K) | |
| Wybuchowe granice | 1–7% |
| Związki pokrewne | |
|
Powiązane alkany
|
|
|
Związki pokrewne
|
|
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
2 -Metyloheksan ( C7H16 heptanu . również , znany jako izoheptan , etyloizobutylometan ) jest izomerem Jest strukturalnie cząsteczką heksanu z grupą metylową przyłączoną do drugiego atomu węgla. Występuje w większości dostępnych na rynku heptanów jako zanieczyszczenie , ale zwykle nie jest uważany za zanieczyszczenie pod względem reakcji, ponieważ ma bardzo podobne właściwości fizyczne i chemiczne w porównaniu z n-heptanem (heptan o prostym łańcuchu).
Będąc alkanem, 2-metyloheksan jest nierozpuszczalny w wodzie , ale jest rozpuszczalny w wielu rozpuszczalnikach organicznych, takich jak alkohole i eter . Jednak 2-metyloheksan jest częściej uważany za rozpuszczalnik . Dlatego, mimo że występuje w wielu dostępnych na rynku produktach heptanowych, nie jest uważany za zanieczyszczenie destrukcyjne, ponieważ heptan jest zwykle stosowany jako rozpuszczalnik. Niemniej jednak, dzięki zwięzłym procesom destylacji i rafinacji , możliwe jest oddzielenie 2-metyloheksanu od n-heptanu.
W grupie izomerów te z większą liczbą rozgałęzień mają tendencję do łatwiejszego zapalania się i pełniejszego spalania . Dlatego 2-metyloheksan ma niższą temperaturę samozapłonu i temperaturę zapłonu w porównaniu z heptanem. Teoretycznie 2-metyloheksan również spala się mniej sadzy, emitując promieniowanie o wyższej częstotliwości; jednakże, ponieważ heptan i 2-metyloheksan różnią się tylko jednym atomem węgla pod względem rozgałęzienia, oba palą się jasnożółtym płomieniem po zapaleniu.
W porównaniu do n-heptanu, 2-metyloheksan ma również niższe temperatury topnienia i wrzenia . Mniejsza gęstość cieczy występuje w 2-metyloheksanie niż w heptanie.
W skali NFPA 704 2-metyloheksan jest wymieniony jako substancja chemiczna o poziomie reaktywności 0, wraz z różnymi innymi alkanami . W rzeczywistości większość alkanów jest niereaktywna, z wyjątkiem ekstremalnych warunków, takich jak spalanie lub silne światło słoneczne . W obecności tlenu i płomienia 2-metyloheksan, podobnie jak heptan, spala się przeważnie całkowicie do wody i dwutlenku węgla . W świetle UV i zmieszaniu z halogenami w rozpuszczalnikach, zwykle bromie w 1,1,1-trichloroetanie , zachodzi reakcja podstawienia .
Zobacz też
- „2-Metyloheksan” . chemexper.com . Źródło 22 listopada 2011 r .
- „Karta charakterystyki substancji niebezpiecznej” (PDF) . ChemADVISOR. Zarchiwizowane od oryginału (PDF) w dniu 21 marca 2006 r . Źródło 22 listopada 2011 r .
- „Izoheptan” . INCHEM: Informacje dotyczące bezpieczeństwa chemicznego od organizacji międzyrządowych . Międzynarodowy program bezpieczeństwa chemicznego. październik 2002 . Źródło 22 listopada 2011 r .
