aldehyd glicerynowy

|
|

|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
aldehyd glicerynowy
|
|
|
Systematyczna nazwa IUPAC
2,3-dihydroksypropanal |
|
| Inne nazwy glicerynowy Aldehyd glicerynowy Gliceryna |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA | 100.000.264 |
|
Identyfikator klienta PubChem
|
|
| UNII |
|
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C3H6O3 _ _ _ _ _ | |
| Masa cząsteczkowa | 90,078 g · mol -1 |
| Gęstość | 1,455 g/cm 3 |
| Temperatura topnienia | 145 ° C (293 ° F; 418 K) |
| Temperatura wrzenia | 140 do 150 ° C (284 do 302 ° F; 413 do 423 K) przy 0,8 mmHg |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Aldehyd glicerynowy ( gliceryna ) to monosacharyd triozy o wzorze chemicznym C 3 H 6 O 3 . Jest to najprostsza ze wszystkich pospolitych aldoz . Jest to słodkie , bezbarwne, krystaliczne ciało stałe , które jest związkiem pośrednim w metabolizmie węglowodanów . Słowo pochodzi od połączenia glicerolu i aldehydu , ponieważ aldehyd glicerynowy to glicerol z jedną grupą alkoholową utlenia się do aldehydu.
Struktura
Aldehyd glicerynowy ma jedno centrum chiralne i dlatego istnieje jako dwa różne enancjomery o przeciwnej skręcalności optycznej:
- W nomenklaturze D / L albo D od łacińskiego Dextera oznaczającego „prawo”, albo L od łacińskiego Laevo oznaczającego „lewo”
- W nomenklaturze R / S albo R od łacińskiego Rectus oznaczającego „prawo”, albo S od łacińskiego Sinister oznaczającego „lewo”
|
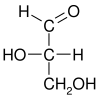
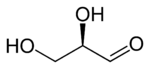
D -gliceroaldehyd ( R )-gliceraldehyd (+)-gliceraldehyd |
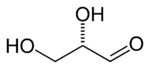
L -gliceraldehyd ( S )-gliceraldehyd (-)-gliceraldehyd |
|
| Projekcja Fischera |

|
|
| Formuła szkieletowa |
|
|
| Model kulki i kija |

|
|
Chociaż skręcalność optyczna aldehydu glicerynowego wynosi (+) dla R i (-) dla S , nie dotyczy to wszystkich monosacharydów. Konfigurację stereochemiczną można określić tylko na podstawie struktury chemicznej, podczas gdy skręcalność optyczną można określić tylko empirycznie (eksperymentalnie).
Szczęśliwym trafem geometria cząsteczkowa D- została przypisana (+)-gliceraldehydowi pod koniec XIX wieku, co zostało potwierdzone przez krystalografię rentgenowską w 1951 roku.
Nomenklatura
W systemie D/L aldehyd glicerynowy jest stosowany jako wzorzec konfiguracyjny węglowodanów. Monosacharydom o konfiguracji absolutnej identycznej z ( R )-gliceroaldehydem w ostatnim stereocentrum, na przykład C5 w glukozie , przypisuje się stereodeskryptor D- . Te podobne do ( S )-gliceraldehydu mają przypisany L- .
Synteza chemiczna
Aldehyd glicerynowy można otrzymać wraz z dihydroksyacetonem przez łagodne utlenianie glicerolu , na przykład za pomocą nadtlenku wodoru i soli żelazawej jako katalizatora . [ potrzebne źródło ]
Jego acetal cykloheksylidenu można również wytwarzać przez utleniające rozszczepienie bis (acetalu) mannitolu .
Biochemia
Enzym dehydrogenaza glicerolowa (NADP + ) ma dwa substraty, glicerol i NADP + oraz 3 produkty, D-gliceraldehyd, NADPH i H+ .
Wzajemna przemiana fosforanów aldehydu glicerynowego ( 3-fosforan aldehydu glicerynowego ) i dihydroksyacetonu ( fosforan dihydroksyacetonu ), katalizowana przez enzym izomerazę triosefosforanową , jest etapem pośrednim glikolizy .