imikwimod
 | |
| Dane kliniczne | |
|---|---|
| Nazwy handlowe | Aldary, inni |
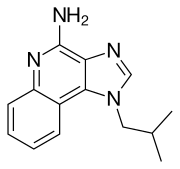
| Inne nazwy | 1-izobutylo-1H - imidazo[4,5- c ]chinolino-4-amina |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a698010 |
| Dane licencyjne | |
| Kategoria ciąży |
|
Drogi podania |
Aktualny |
| Kod ATC | |
| Status prawny | |
| Status prawny | |
| Dane farmakokinetyczne | |
| Okres półtrwania w fazie eliminacji | 30 godzin (dawka miejscowa), 2 godziny (dawka podskórna) |
| Identyfikatory | |
| |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| IUPHAR/BPS | |
| Bank Leków | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CHEBI | |
| CHEMBL | |
| Pulpit nawigacyjny CompTox ( EPA ) | |
| Karta informacyjna ECHA | 100.131.047 |
| Dane chemiczne i fizyczne | |
| Formuła | C 14 H 16 N 4 |
| Masa cząsteczkowa | 240,310 g·mol -1 |
| Model 3D ( JSmol ) | |
| |
| |
Imikwimod , sprzedawany między innymi pod marką Aldara , to lek , który działa jako modyfikator odpowiedzi immunologicznej , stosowany w leczeniu brodawek narządów płciowych , powierzchownego raka podstawnokomórkowego i rogowacenia słonecznego . Naukowcy z 3M odkryli lek, a firma 3M uzyskała pierwszą aprobatę FDA w 1997 r. Od 2015 r. imikwimod jest lekiem generycznym i jest dostępny na całym świecie pod wieloma markami.
Zastosowania medyczne
Imikwimod jest stosowanym przez pacjenta kremem przepisywanym w leczeniu brodawek narządów płciowych , choroby Bowena ( rak płaskonabłonkowy in situ) oraz, wtórnie do operacji, raka podstawnokomórkowego , jak również rogowacenia słonecznego .
Imiquimod 5% krem jest wskazany do miejscowego leczenia:
- brodawki zewnętrznych narządów płciowych i okolicy odbytu (kłykcin kończystych) u dorosłych;
- małe powierzchowne raki podstawnokomórkowe (sBCC) u dorosłych;
- typowe klinicznie, niehiperkeratotyczne, nie przerostowe rogowacenie słoneczne (AK) na twarzy lub skórze głowy u osób dorosłych z prawidłową odpornością, gdy wielkość lub liczba zmian ogranicza skuteczność i/lub dopuszczalność krioterapii, a inne miejscowe opcje leczenia są przeciwwskazane lub mniej odpowiednie.
Imiquimod 3,75% krem jest wskazany do miejscowego leczenia typowego klinicznie, niehiperkeratotycznego, niehipertroficznego, widocznego lub wyczuwalnego palpacyjnie rogowacenia słonecznego całej twarzy lub łysiejącej skóry głowy u osób dorosłych z prawidłową odpornością, gdy inne opcje leczenia miejscowego są przeciwwskazane lub mniej odpowiednie.
Skutki uboczne
Działania niepożądane obejmują miejscowe reakcje zapalne, takie jak pęcherze, pieczenie, zaczerwienienie skóry, suchość skóry, swędzenie, pękanie skóry, tworzenie się strupów lub strupów, drenaż skóry, łuszczenie się lub łuszczenie się skóry, owrzodzenia skóry, rany, obrzęki, a także układowe reakcje, takie jak gorączka, objawy grypopodobne, ból głowy i zmęczenie.
Osoby, które przeszły przeszczep narządu i przyjmują leki immunosupresyjne, nie powinny stosować imikwimodu.
Mechanizm akcji
Imikwimod wykazuje głębokie działanie przeciwnowotworowe poprzez synergistyczne działanie na kilku poziomach immunologicznych. Imikwimod stymuluje wrodzony układ odpornościowy poprzez aktywację receptora toll-like 7 (TLR7), powszechnie zaangażowanego w rozpoznawanie patogenów. Komórki aktywowane przez imikwimod poprzez TLR-7 wydzielają cytokiny (głównie interferon-α (IFN-α), interleukinę-6 (IL-6) i czynnik martwicy nowotworu-α (TNF-α)). Istnieją dowody na to, że imikwimod zastosowany na skórę może prowadzić do aktywacji komórek Langerhansa , które następnie migrują do lokalnych węzłów chłonnych, aby aktywować adaptacyjny układ odpornościowy . Inne typy komórek aktywowane przez imikwimod obejmują komórki NK , makrofagi i limfocyty B .
Imikwimod wywiera swoje działanie poprzez zwiększenie poziomu receptora opioidowego czynnika wzrostu (OGFr). W eksperymentach zablokowanie funkcji OGFr za pomocą siRNA spowodowało utratę jakiegokolwiek działania antyproliferacyjnego imikwimodu.
Historia
Naukowcy z działu farmaceutycznego firmy 3M odkryli imikwimod w ramach programu odkrywania inhibitorów replikacji wirusa opryszczki pospolitej w oparciu o znaną pochodną adeniny . Firma 3M uzyskała dla niego pierwszą aprobatę FDA w 1997 r. jako lek na brodawki zewnętrznych narządów płciowych i okolic odbytu pod marką „Aldara”. W 2004 roku firma 3M uzyskała zgodę FDA na wprowadzenie imikwimodu na rynek jako lek do leczenia powierzchownego raka podstawnokomórkowego .
W 2006 roku firma 3M sprzedała swoją działalność farmaceutyczną w obu Amerykach firmie Graceway Pharmaceuticals , swoją działalność farmaceutyczną w Europie firmie Meda AB oraz działalność farmaceutyczną na innych terytoriach dwóm firmom private equity .
Graceway ogłosił upadłość w 2011 roku, po wygaśnięciu patentów na imikwimod, a jego aktywa, w tym prawa do marki imikwimodu i zezwolenia w obu Amerykach, zostały zakupione przez Medicis Pharmaceutical .
Imikwimod 5% został dopuszczony do użytku medycznego w Unii Europejskiej we wrześniu 1998 roku. Imikwimod 3,75% został dopuszczony do użytku medycznego w Unii Europejskiej w sierpniu 2012 roku.
Od 2015 roku imikwimod jest lekiem generycznym i jest dostępny na całym świecie pod wieloma markami.
Badania
W jednym randomizowanym badaniu klinicznym fazy III z podwójnie ślepą próbą wykazano, że eliminacja kłykcin kończystych (wskazanie zatwierdzone przez FDA) poprawiła się z 9% w przypadku placebo do 24,9% w przypadku kremu zawierającego 3,75% imikwimodu stosowanego przez okres do ośmiu tygodni.
Imikwimod został przetestowany pod kątem leczenia mięczaka zakaźnego . Jednak w dwóch dużych randomizowanych badaniach kontrolowanych nie znaleziono dowodów na skuteczność imikwimodu w leczeniu dzieci z mięczakiem zakaźnym, a także odnotowano działania niepożądane. Te obalają wcześniejsze niepotwierdzone twierdzenia i mniejsze, mniej wiarygodne badania.
Imikwimod był również testowany w leczeniu śródnabłonkowej neoplazji sromu , śródnabłonkowej neoplazji pochwy , brodawek pospolitych (w przeglądzie Cochrane z 2012 r. pod i wokół paznokci rąk i stóp. Od 2014 r. Nie ma wystarczających dowodów, aby zalecić leczenie brodawek (innych niż brodawki narządów płciowych) imikwimodem, ze względu na niewielki rozmiar i brak kontroli w istniejących badaniach.
Linki zewnętrzne
- „Imikwimod” . Portal informacyjny o lekach . Narodowa Biblioteka Medyczna Stanów Zjednoczonych.
- DermNet /imikwimod