laminopatia
 | |
| Laminopatia | |
|---|---|
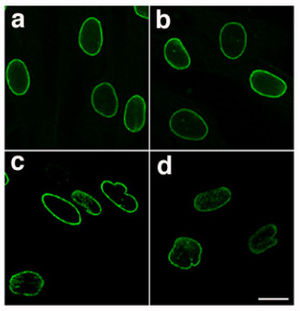
| Normalna blaszka jądrowa (a i b) i zmutowana blaszka jądrowa (c i d) od pacjenta z HGPS , uwidoczniona za pomocą immunofluorescencji - zwróć uwagę na nieregularny i nierówny kształt laminopatycznych jąder | |
| Specjalność | Genetyka kliniczna |
| Objawy | Osłabienie mięśni , osłabienie czucia, duszność , omdlenie |
| Komplikacje | Cukrzyca , niewydolność serca , arytmie |
| Zwykły początek | Zmienny |
| Czas trwania | Trwający całe życie |
| Powoduje | Genetyczny |
| Metoda diagnostyczna | Badania kliniczne, genetyczne |
| Leczenie | Fizjoterapia , chirurgia ortopedyczna , rozrusznik serca , wszczepialny defibrylator |
| Lek | Inhibitor ACE , beta-bloker , antagonista aldosteronu |
| Rokowanie | Zmienny |
Laminopatie ( lamino- + -opatie ) to grupa rzadkich chorób genetycznych spowodowanych mutacjami w genach kodujących białka blaszki jądrowej . Są one objęte bardziej ogólnym terminem envelopatie jądrowe , który został ukuty w 2000 r. dla chorób związanych z defektami otoczki jądrowej . Od czasu pojawienia się pierwszych doniesień o laminopatiach pod koniec lat 90. XX wieku, wzmogono wysiłki badawcze mające na celu odkrycie istotnej roli białek otoczki jądrowej w integralności komórek i tkanek zwierząt.
Objawy i oznaki
Laminopatie i inne enwelopatie jądrowe mają wiele różnych objawów klinicznych, w tym dystrofię mięśni szkieletowych i/lub serca , lipodystrofię i cukrzycę , dysplazję , dermo- lub neuropatię , leukodystrofię i progerię (przedwczesne starzenie). Większość z tych objawów rozwija się po urodzeniu, zwykle w dzieciństwie lub w okresie dojrzewania. Niektóre laminopatie mogą jednak prowadzić do przedwczesnej śmierci, a mutacje laminatu B1 ( LMNB1 ) mogą być śmiertelne przed lub po urodzeniu.
Genetyka
Pacjenci z klasyczną laminopatią mają mutacje w genie kodującym laminat A/C ( gen LMNA ). [ potrzebne źródło ]
Mutacje w genie kodującym laminat B 2 (gen LMNB2) powiązano z zespołem Barraquera-Simonsa, a duplikacja w genie kodującym laminat B1 (gen LMNB1) powoduje autosomalną dominującą leukodystrofię.
Mutacje związane z innymi enwelopatiami jądrowymi stwierdzono w genach kodujących białka wiążące laminę, takie jak receptor laminy B (gen LBR), emeryna (gen EMD) i białko zawierające domenę LEM 3 (gen LEMD3) oraz enzymy przetwarzające prelaminę A, takie jak metaloproteinaza cynkowa STE24 (gen ZMPSTE24).
Mutacje powodujące laminopatie obejmują zarówno recesywne , jak i dominujące allele z rzadkimi mutacjami de novo, tworzącymi dominujące allele, które nie pozwalają ich nosicielom rozmnażać się przed śmiercią. [ potrzebne źródło ]
Envelopatia jądrowa o największej częstotliwości w populacjach ludzkich to dystrofia mięśniowa Emery'ego-Dreifussa spowodowana mutacją sprzężoną z X w genie EMD kodującym emerynę i dotykająca szacunkowo 1 na 100 000 osób. [ potrzebne źródło ]
Mechanizm molekularny
Laminy to białka włókien pośrednich , które tworzą rusztowanie blaszki jądrowej pod otoczką jądrową w komórkach zwierzęcych. Są przyłączone do błony otoczki jądrowej za pomocą kotwic farnezylowych i interakcji z białkami wewnętrznej błony jądrowej, takimi jak receptor laminatu B i emeryna. Wydaje się, że blaszka jądrowa jest przystosowaniem do poruszania się zwierząt, ponieważ organizmy siedzące, takie jak rośliny lub grzyby , nie mają blaszek, a objawy wielu laminopatii obejmują mięśnie wady. Mutacje w tych genach mogą prowadzić do defektów w składaniu włókien i/lub przyczepianiu się do otoczki jądrowej, a tym samym zagrażać stabilności otoczki jądrowej w tkankach poddawanych obciążeniom fizycznym, takich jak włókna mięśniowe , kości , skóra i tkanka łączna .
Informacyjny RNA wytwarzany z genu LMNA podlega alternatywnemu splicingowi i ulega translacji do lamin A i C. Lamin A ulega farnezylacji w celu przyłączenia kotwicy błonowej do białka. Ta wersja białka jest również określana jako prelamina A. Farnezylowana prelamina A jest dalej przetwarzana w dojrzałą laminę A przez metaloproteinazę usuwającą ostatnie 15 aminokwasów i jej farnezylowaną cysteinę . Pozwala to laminatowi A na oddzielenie się od błony otoczki jądrowej i pełnienie funkcji jądrowych. Mutacje powodujące laminopatie zakłócają te procesy na różnych poziomach. [ potrzebne źródło ]
Mutacje nonsensowne i missense
Mutacje zmiany sensu w domenach pręcika i ogona laminatu A/C są przyczyną szerokiej gamy zaburzeń genetycznych, co sugeruje, że białko laminatu A/C zawiera odrębne domeny funkcjonalne, które są niezbędne do utrzymania i integralności różnych linii komórkowych. Wydaje się, że interakcja między laminatem A a emeryną białka otoczki jądrowej ma kluczowe znaczenie w komórkach mięśniowych, przy czym pewne mutacje w laminacie naśladują mutacje w emerynie i powodują dystrofię mięśniową Emery'ego-Dreifussa . Różne mutacje prowadzą do dominujących alleli negatywnych i recesywnych. Mutacje w domenie pręta laminatu prowadzące do błędnej lokalizacji zarówno laminatu A, jak i emeryny występują u pacjentów z autosomalnymi dominującymi postaciami dystrofii mięśniowej i kardiomiopatii. [ potrzebne źródło ]
Większość mutacji laminatu B wydaje się być śmiertelna, a mutacje w laminacie B1 powodują śmierć myszy przy urodzeniu. W 2006 roku u pacjentów z nabytą częściową lipodystrofią zidentyfikowano mutacje zmiany sensu laminatu B2.
Mutacje punktowe
Najczęstszą mutacją w laminie A/C jest homozygotyczna substytucja Arg527His (arginina zastąpiona histydyną w pozycji 527) w eksonie 9 genu LMNA. Inne znane mutacje to Ala529Val i Arg527His/Val440Met. Ponadto niektóre mutacje, takie jak Arg527Cys, Lys542Asn, Arg471Cys, Thr528Met/Met540Thr i Arg471Cys/Arg527Cys, Arg527Leu, powodują dysplazję żuchwowo-krzyżową z cechami podobnymi do progerii .
Wady splotu
Mutacje powodujące progerię są wadliwe w splicingu mRNA LMNA, w związku z czym wytwarzają nieprawidłowe białko laminatu A, znane również jako progeryna . Mutacje aktywują tajemnicze miejsce splicingowe w eksonie 11 genu, powodując w ten sposób usunięcie miejsca przetwarzania na prelaminie A. Powoduje to nagromadzenie progeryny, która nie jest w stanie dojrzewać do laminy A, co prowadzi do zniekształcenia jąder. Błędne składanie prowadzi również do całkowitej lub częściowej utraty eksonu 11 i skutkuje skróceniem białka prelaminy A w zespole śmiertelnego przykurczu skóry noworodków.
Wady przetwarzania
Ponieważ metaloproteinaza STE24 jest wymagana do przetwarzania prelaminy A w dojrzałą laminę A, mutacje w tym genie znoszące aktywność proteazy powodują defekty podobne do laminopatii powodowanych przez prelaminę A z obciętymi miejscami przetwarzania. Objawy u pacjentów z mutacją ZMPSTE24 wahają się od dysplazji żuchwowo-krzyżowej, wyglądu progeroidalnego i uogólnionej lipodystrofii do śmiertelnej dla niemowląt restrykcyjnej dermopatii . [ potrzebne źródło ]
Efekty dawkowania genów
W przypadku leukodystrofii dziedziczonej autosomalnie dominująco choroba jest związana z duplikacją genu laminatu B LMNB1. Wydaje się, że dokładna dawka laminatu B w komórkach ma kluczowe znaczenie dla integralności jądra, ponieważ zwiększona ekspresja laminatu B powoduje degeneracyjny fenotyp muszek owocowych i prowadzi do nieprawidłowej morfologii jądra.
Przeciwciała autoimmunologiczne
Przeciwciała przeciwko laminom są wykrywane w surowicach niektórych osób z chorobami autoimmunologicznymi .
naprawa DNA
Laminaty typu A promują stabilność genetyczną, utrzymując poziomy białek, które odgrywają kluczową rolę w naprawie pęknięć dwuniciowych DNA podczas procesów łączenia niehomologicznych końców i rekombinacji homologicznej . Mutacje w laminie A (LMNA) powodują zespół progerii Hutchinsona-Gilforda , dramatyczną postać przedwczesnego starzenia. Komórki myszy z niedoborem dojrzewania prelaminy A wykazują zwiększone uszkodzenia DNA i aberracje chromosomowe i są bardziej wrażliwe na czynniki uszkadzające DNA. Niezdolność do odpowiedniej naprawy uszkodzeń DNA, gdy laminaty typu A są wadliwe, jest prawdopodobnie odpowiedzialna za niektóre aspekty przedwczesnego starzenia. [ potrzebne źródło ]
Diagnoza
Rodzaje znanych laminopatii i innych envelopatii jądrowych
| Zespół | Identyfikator OMIM | Objawy | Mutacja w | zidentyfikowany w |
|---|---|---|---|---|
| Nietypowy zespół Wernera | 277700 | Progeria o zwiększonym nasileniu w porównaniu z normalnym zespołem Wernera | Klimatyzacja laminowana | 2003 |
| Zespół Barraquera-Simonsa | 608709 | Lipodystrofia | Lamin B2 | 2006 |
| Zespół Buschkego-Ollendorffa | 166700 | Dysplazja szkieletowa , zmiany skórne | Domena LEM zawierająca białko 3 (białko wiążące laminy) | 2004 |
| Kardiomiopatia rozstrzeniowa z miopatią mięśnia czworogłowego | 607920 | Kardiomiopatia | Klimatyzacja laminowana | 2003 |
| Choroba Charcota-Mariego-Tootha , aksonalna, typ 2B1 | 605588 | Neuropatia | Klimatyzacja laminowana | 2002 |
| Dystrofia mięśniowa Emery'ego-Dreifussa sprzężona z chromosomem X (EDMD) | 310300 | Dystrofia mięśni szkieletowych i sercowych | Emerin (białko wiążące laminy) | 1996, 2000 |
| Dystrofia mięśniowa Emery'ego-Dreifussa , autosomalna dominująca (EDMD2) | 181350 | Dystrofia mięśni szkieletowych i sercowych | Klimatyzacja laminowana | 1999 |
| Dystrofia mięśniowa Emery'ego-Dreifussa , autosomalna recesywna (EDMD3) | 604929 | Dystrofia mięśni szkieletowych i sercowych | Klimatyzacja laminowana | 2000 |
| Rodzinna częściowa lipodystrofia typu Dunnigana (FPLD) | 151660 | Cukrzyca lipoatroficzna | Klimatyzacja laminowana | 2002 |
| Dysplazja Greenberga | 215140 | Dysplazja szkieletowa | Receptor laminy B | 2003 |
| Zespół progerii Hutchinsona-Gilforda (HGPS) | 176670 | Progeria | Klimatyzacja laminowana | 2003 |
| Leukodystrofia demielinizacyjna, początek w wieku dorosłym, autosomalny dominujący (ADLD) | 169500 | Postępująca choroba demielinizacyjna wpływająca na ośrodkowy układ nerwowy | Lamin B1 (duplikacja genów tandemowych) | 2006 |
| Dystrofia mięśniowo-kończynowa typu 1B (LGMD1B) | 159001 | Dystrofia mięśniowa bioder i barków, kardiomiopatia | Klimatyzacja laminowana | 2000 |
| Lipoatrofia z cukrzycą, stłuszczeniem wątroby, kardiomiopatią przerostową i grudkami leukomelanodermicznymi (LDHCP) | 608056 | Cukrzyca lipoatroficzna , stłuszczenie wątroby , kardiomiopatia przerostowa , zmiany skórne | Klimatyzacja laminowana | 2003 |
| Dysplazja żuchwowo-krzyżowa z lipodystrofią typu A (MADA) | 248370 | Dysplazja i lipodystrofia | Klimatyzacja laminowana | 2002 |
| Dysplazja żuchwowo-krzyżowa z lipodystrofią typu B (MADB) | 608612 | Dysplazja i lipodystrofia | Metaloproteaza cynku STE24 (enzym przetwarzający prelaminę) | 2003 |
| Anomalia Pelgera-Hueta (PHA) | 169400 | Mielodysplazja | Receptor laminy B | 2002 |
| Dermopatia restrykcyjna , śmiertelna | 275210 | Dermopatia | Lamin A/C lub metaloproteaza cynku STE24 (enzym przetwarzający prelaminę) | 2004 |
Leczenie
Obecnie nie ma lekarstwa na laminopatie, a leczenie jest w dużej mierze objawowe i wspomagające. U pacjentów z dystrofiami mięśniowymi pomocna może być fizjoterapia i/lub korekcyjna operacja ortopedyczna . Laminopatie wpływające na mięsień sercowy mogą powodować niewydolność serca wymagającą leczenia lekami, w tym inhibitorami ACE , beta-blokerami i antagonistami aldosteronu , podczas gdy zaburzenia rytmu serca , które często występują u tych pacjentów, mogą wymagać wszczepienia rozrusznika serca lub wszczepialny defibrylator . Leczenie neuropatii może obejmować leki na drgawki i spastyczność . [ potrzebne źródło ]
Badania
Niedawne postępy w odkrywaniu molekularnych mechanizmów tworzenia się toksycznej progeryny w laminopatiach prowadzących do przedwczesnego starzenia się otworzyły możliwości rozwoju leczenia celowanego. Farnezylacja prelaminy A i jej patologicznej postaci progeryny jest przeprowadzana przez enzym transferazę farnezylową . Inhibitory transferazy farnezylowej (FTI) można skutecznie stosować w celu zmniejszenia objawów progerii w dwóch mysich systemach modelowych oraz w celu odwrócenia nieprawidłowej morfologii jądra w hodowlach komórek progeroidów. Dwa doustne FTI, lonafarnib i tipifarnib , są już stosowane jako leki przeciwnowotworowe u ludzi i mogą stać się drogami leczenia dzieci z progerią laminopatyczną. Leki bisfosforanowe zawierające azot stosowane w leczeniu osteoporozy zmniejszają wytwarzanie farnezylodifosforanu , a tym samym farnezylację prelaminy A. Testowanie tych leków może udowodnić, że są one również przydatne w leczeniu progerii. Zastosowanie antysensownych oligonukleotydów do hamowania syntezy progeryny w dotkniętych komórkach to kolejna droga obecnych badań nad rozwojem leków anty-progeryny.