Dystrofia mięśniowa kończyn dolnych
| Dystrofia mięśniowa kończyn dolnych | |
|---|---|
| Inne nazwy | Dystrofia mięśniowa Erba |
 | |
| Białko MYOT (znane również jako TTID, jeden z wielu genów, których mutacje są odpowiedzialne za ten stan) | |
| Specjalność | Neurologia, medycyna nerwowo-mięśniowa |
| Objawy | Osłabienie mięśni miednicy |
| Czas trwania | Trwający całe życie |
| typy | 32 rodzaje |
| Powoduje | Mutacje genetyczne |
| Metoda diagnostyczna | Testy genetyczne i ewentualnie biopsja mięśnia |
| Diagnostyka różnicowa | Dystrofie mięśniowe: Duchenne'a , Beckera , twarzowo-łopatkowo-ramiennego , Emery'ego-Dreifussa ; choroba Pompego ; wrodzony zespół miasteniczny ; neuropatia ruchowa |
| Leczenie | Terapia zajęciowa, logopedia i fizjoterapia |
| Częstotliwość | 2,27-10 na 100 000 |
Dystrofia mięśniowo-obręczowa ( LGMD ) to genetycznie heterogenna grupa rzadkich dystrofii mięśniowych , które mają wspólny zestaw cech klinicznych. Charakteryzuje się postępującym zanikiem mięśni , który dotyczy głównie mięśni bioder i ramion. LGMD zwykle ma autosomalny wzór dziedziczenia . Obecnie nie ma znanego lekarstwa ani leczenia.
Symptomy i objawy
Z definicji wszystkie dystrofie mięśniowe obręczy kończyn (LGMD) powodują postępujące osłabienie proksymalne, co oznacza osłabienie mięśni na tułowiu lub w jego pobliżu, które pogarsza się z czasem. Wyraźnie LGMD preferencyjnie wpływa na mięśnie obręczy biodrowej , uda , obręczy barkowej i/lub ramienia . Osłabienie mięśni jest na ogół symetryczne. Zwykle pas biodrowy jest pierwszym obszarem, który wykazuje osłabienie, objawiające się trudnościami w chodzeniu, wchodzeniu i / lub schodzeniu po schodach, wstawaniu z krzesła, zginaniu się w talii lub kucaniu. Z powodu tych trudności często dochodzi do upadków. Osłabienie obręczy barkowej może utrudniać lub uniemożliwiać podnoszenie przedmiotów, a nawet podnoszenie ramion. Szybkość progresji jest różna u różnych pacjentów. W końcu zdolność do biegania i chodzenia może ulec pogorszeniu. Choroba często prowadzi do uzależnienia od wózka inwalidzkiego w ciągu kilku lat od wystąpienia objawów, chociaż niektórzy pacjenci zachowują mobilność. Ostatecznie choroba może wpływać na inne mięśnie, takie jak zlokalizowane na twarzy .
Z definicji LGMD wpływają przede wszystkim na mięśnie szkieletowe , chociaż niektóre podtypy mogą mieć wpływ na mięsień sercowy w mniejszym stopniu, co może powodować kołatanie serca
Między podtypami LGMD, a nawet w obrębie dowolnego podtypu LGMD, może występować znaczna zmienność cech i ciężkości choroby. Dodatkowe możliwe prezentacje obejmują:
- Pseudohipertrofia
- Hipertrofia mięśniowa
- Problemy z mięśniami oddechowymi
- Dyskomfort dolnej części pleców
- Dystalne problemy z mięśniami
- Skrzydlata łopatka
W większości przypadków ból nie występuje w przypadku LGMD, a funkcje umysłowe nie są zaburzone. LGMD może rozpocząć się w dzieciństwie, okresie dojrzewania, wczesnej dorosłości lub nawet później, wiek zachorowania wynosi zwykle od 10 do 30 lat. Obie płcie są dotknięte w równym stopniu. Kiedy dystrofia mięśniowa obręczy kończyn rozpoczyna się w dzieciństwie, postęp wydaje się być szybszy, a choroba bardziej upośledzająca. Kiedy zaburzenie zaczyna się w okresie dojrzewania lub w wieku dorosłym, choroba na ogół nie jest tak ciężka i postępuje wolniej. Podczas prezentacji nie ma neuropatii czuciowej ani dysfunkcji autonomicznej lub trzewnej. [ wymagany cytat medyczny ]
Genetyka
LGMD jest zaburzeniem genetycznym i dziedzicznym , spowodowanym jedną z wielu mutacji genetycznych białek biorących udział w funkcjonowaniu mięśni. Wszystkie obecnie zidentyfikowane LGMD mają wzorzec dziedziczenia, który jest dominujący lub recesywny , chociaż definicja LGMD pozwala na zaklasyfikowanie chorób o bardziej skomplikowanych wzorach dziedziczenia jako LGMD. Mutacje patogenne występują głównie w regionach kodujących, ale odnotowano również niekodujące warianty przyczynowe. W Euroazji mutacje CAPN3 są najczęstszą przyczyną LGMD, jednak w północnej Europie bardzo często występują mutacje w FKRP.
Diagnoza
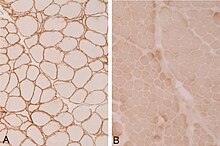
Rozpoznanie dystrofii mięśniowej kończyn i obręczy można przeprowadzić za pomocą biopsji mięśnia , która wykaże obecność dystrofii mięśniowej, a testy genetyczne służą do określenia, jaki typ dystrofii mięśniowej ma pacjent. Immunohistochemiczne testy dystrofiny mogą wskazywać na spadek dystrofiny wykrywany w sarkoglikanopatiach . Jeśli chodzi o sarkoglikanu , może występować zmienność (jeśli α-sarkoglikan i γ-sarkoglikan nie są obecne, oznacza to mutację w LGMD2D).
z 2014 r .: Rozpoznawanie i leczenie dystrofii kończynowo-obręczowych i dystalnych wskazuje, że osoby z podejrzeniem choroby dziedzicznej powinny poddać się badaniom genetycznym. Inne testy/analizy to:
- Wysoki poziom CK (x10-150 razy normalny)
- MRI może wskazywać na różne typy LGMD.
- EMG może potwierdzić miopatyczny charakter choroby.
- Elektrokardiografia (mogą wystąpić zaburzenia rytmu serca w LGMD1B)
typy
Rodzina „LGMD D” jest autosomalna dominująca , a rodzina „LGMD R” jest autosomalna recesywna . Dystrofię mięśniową obręczy kończyn dolnych wyjaśniono w kategoriach genu, locus, OMIM i typu w następujący sposób:
| Nazwa | Dziedzictwo | Stara nazwa | OMIM | Gen | Gen zaangażowany również w: | Notatki |
|---|---|---|---|---|---|---|
| Związany z LGMD D1 DNAJB6 | Autosomalny dominujący | LGMD1D | 603511 | DNAJB6 | ||
| Związane z LGMD D2 TNP03 | LGMD1F | 608423 | TNPO3 | |||
| Związane z LGMD D3 HNRNPDL | LGMD1G | 609115 | HNRPDL | |||
| Związane z LGMD D4 calpain3 | LGMD1I | 618129 | CAPN3 | LGMD R1 | Nazywana również „autosomalną dominującą kalpainopatią ”. | |
| LGMD D5 związany z kolagenem 6 | Dominująca miopatia Bethlema | 158810 | COL6A1 , COL6A2 , COL6A3 | Wrodzona dystrofia mięśniowa , LGMD R22 | ||
| Związany z LGMD R1 calpain3 | Autosomalny recesywny | LGMD2A | 253600 | CAPN3 | LGMD D4 | Nazywana również „autosomalną recesywną kalpainopatią”. |
| Dysferlina związana z LGMD R2 | LGMD2B | 253601 | DYSF | Miopatia Miyoshi typu 1 (MMD1 - 254130 ). | Dysferlinopatia | |
| LGMD R3 związane z α-sarkoglikanem | LGMD2D | 608099 | SGCA | sarkoglikanopatie | ||
| LGMD R4 β-powiązany z sarkoglikanem | LGMD2E | 604286 | SGCB | |||
| LGMD R5 γ -związany z sarkoglikanem | LGMD2C | 253700 | SGCG | |||
| LGMD R6 związany z δ-sarkoglikanem | LGMD2F | 601287 | SGCD | |||
| LGMD R7 związane z telethoniną | LGMD2G | 601954 | TCAP | |||
| Związane z LGMD R8 TRIM 32 | LGMD2H | 254110 | PRZYTNIJ32 | |||
| Związane z LGMD R9 FKRP | LGMD2I | 607155 | FKRP | Wrodzona dystrofia mięśniowa | α-dystroglikanopatia | |
| LGMD R10 związane z titiną | LGMD2J | 608807 | TTN | Wrodzona miopatia | ||
| Związane z LGMD R11 POMT1 | LGMD2K | 609308 | POMT1 | Wrodzona dystrofia mięśniowa | α-dystroglikanopatia | |
| LGMD R12 związany z anoktaminą5 | LGMD2L | 611307 | ANO5 | Miopatia Miyoshi typu 3 (MMD3 - 613319 ) | ||
| Związany z LGMD R13 Fukutin | LGMD2M | 611588 | FKTN | Wrodzona dystrofia mięśniowa | α-dystroglikanopatia | |
| Związane z LGMD R14 POMT2 | LGMD2N | 607439 | POMT2 | Wrodzona dystrofia mięśniowa | α-dystroglikanopatia | |
| Związane z LGMD R15 POMGnT1 | LGMD2O | 606822 | POMGNT1 | Wrodzona dystrofia mięśniowa | α-dystroglikanopatia | |
| LGMD R16 związane z α-dystroglikanem | LGMD2P | 613818 | DAG1 | Wrodzona dystrofia mięśniowa | α-dystroglikanopatia | |
| LGMD R17 związane z plektyną | LGMD2Q | 613723 | PLEC1 | |||
| Związane z LGMD R18 TRAPPC11 | LGMD2S | 615356 | TRAPPC11 | |||
| Związane z LGMD R19 GMPPB | LGMD2T | 615352 | GMPPB | Wrodzona dystrofia mięśniowa | α-dystroglikanopatia | |
| Związane z LGMD R20 ISPD | LGMD2U | 616052 | ISPD | Wrodzona dystrofia mięśniowa | α-dystroglikanopatia | |
| Związany z LGMD R21 POGLUT1 | LGMD2Z | 617232 | POGLUT1 | |||
| LGMD R22 związany z kolagenem 6 | Miopatia Bethlema recesywna | COL6A1 , COL6A2 , COL6A3 | Wrodzona dystrofia mięśniowa, LGMD D5 | |||
| LGMD R23 związane z lamininą α2 | Dystrofia mięśniowa związana z lamininą α2 | 156225 | LAMA2 | Wrodzona dystrofia mięśniowa | ||
| Związany z LGMD R24 POMGNT2 | Dystrofia mięśniowa związana z POMGNT2 | 618135 | POMGNT2 | Wrodzona dystrofia mięśniowa | α-dystroglikanopatia | |
| LGMD R25 | LGMD2X | POPDC1 | ||||
| LGMD R26 | POPDC3 | |||||
| LGMD R27 | JAG2 | |||||
| LGMD R (numer w toku) | PYROXD1 |
Kryteria LGMD
Aby jednostka chorobowa została sklasyfikowana jako LGMD, muszą być spełnione następujące kryteria:
- genetyczny, z możliwym do zidentyfikowania wzorcem dziedziczenia, takim jak autosomalny dominujący, autosomalny recesywny, digeniczny lub poligeniczny.
- stosunkowo selektywny dla mięśni szkieletowych
- głównie zajęcie mięśni proksymalnych
- niezależne chodzenie osiąga się w pewnym momencie życia
- podwyższona kinaza kreatynowa w surowicy
- utrata włókien mięśniowych
- zmiany dystroficzne w histologii mięśni
- zmiany zwyrodnieniowe w obrazowaniu medycznym
- patologia w końcowym stadium obserwowana w najbardziej dotkniętych mięśniach
- opisane w co najmniej dwóch niespokrewnionych rodzinach
Mechanizm różnicowy
Wiele chorób może objawiać się podobnie do LGMD. Dystrofinopatie , w tym dystrofia mięśniowa Duchenne'a , dystrofia mięśniowa Beckera i manifestująca się dystrofinopatia u nosicielek, mogą objawiać się podobnie do LGMD. Dystrofia mięśniowa twarzowo-łopatkowo-ramienna może wyglądać podobnie, zwłaszcza gdy oszczędza mięśnie twarzy. W różnicowaniu występują również dystrofie mięśniowe Emery'ego-Dreifussa , choroba Pompego , wrodzone zespoły miasteniczne o późniejszym początku oraz proksymalne dominujące dziedziczne neuropatie ruchowe .
Leczenie
Istnieje niewiele badań potwierdzających skuteczność ćwiczeń w przypadku dystrofii mięśniowej kończyn dolnych. Jednak badania wykazały, że ćwiczenia fizyczne mogą w rzeczywistości trwale uszkodzić mięśnie z powodu intensywnego skurczu mięśni. Fizjoterapia może być wymagana, aby utrzymać jak największą siłę mięśni i elastyczność stawów. Suwmiarki mogą być stosowane w celu utrzymania mobilności i jakości życia. Wymagana jest uważna uwaga na zdrowie płuc i serca, kortykosteroidy u osób z LGMD 2C-F wykazują pewną poprawę. Dodatkowo osoby mogą śledzić następujące zarządzanie :
- Terapia zajęciowa
- Terapia oddechowa
- Terapia mowy
- Nie należy dążyć do przeciwciał neutralizujących miostatynę
Sarkoglikanopatie mogą być prawdopodobnie podatne na terapię genową .
Rokowanie
Jeśli chodzi o rokowanie w przypadku dystrofii mięśniowej kończyn dolnych w jej najłagodniejszej postaci, osoby dotknięte chorobą mają prawie normalną siłę i funkcję mięśni. LGMD nie jest zazwyczaj chorobą śmiertelną, chociaż może ostatecznie osłabić serce i mięśnie oddechowe , prowadząc do choroby lub śmierci z powodu zaburzeń wtórnych.
Epidemiologia
Minimalna częstość występowania dystrofii mięśniowej kończyn dolnych jako grupy prawdopodobnie waha się od 2,27-10 na 100 000 (1:44 000 do 1:10 000). LGMD jest czwartą najczęściej występującą dystrofią mięśniową, po dystrofinopatiach, dystrofiach miotonicznych i dystrofia mięśniowa twarzowo-łopatkowo-ramienna. Częstość występowania poszczególnych LGMD, badana w Stanach Zjednoczonych, w kolejności malejącej, wynika z mutacji 1) kalpainy, 2) dysferliny, 3) kolagenu VI, 4) sarkoglikanów, 5) anoktaminy 5 i 6) fukutyny- pokrewne białko. W Euroazji mutacje CAPN3 są najczęstszą przyczyną LGMD, jednak w północnej Europie bardzo często występują mutacje w FKRP. Trudno jest obliczyć ogólnoświatowe rozpowszechnienie nawet najbardziej powszechnych typów LGMD, ze względu na efekt założycielski powodujący zróżnicowaną częstość występowania w zależności od regionu. Rzadziej spotykane typy są bardzo rzadkie, często opisywane są tylko ograniczone regiony świata.
Historia
Termin „dystrofia mięśniowa obręczy kończyn” został opublikowany w 1954 r., opisując grupę heterogennych stanów, które klinicyści zauważyli jako odrębne od dystrofii mięśniowej Duchenne'a, dystrofii mięśniowo-twarzowo-łopatkowo-ramiennej i dystrofii miotonicznej. Genetykę LGMD zaczęto rozumieć pod koniec XX wieku, co skłoniło Europejskie Centrum Nerwowo-mięśniowe (ENMC) do ustanowienia konsensusu w sprawie klasyfikacji LGMD w 1995 r. Schemat klasyfikacji w tamtym czasie oznaczał LGMD autosomalne dominujące jako „LGMD1” i autosomalny recesywny LGMD jako „LGMD2”. Do nazw LGMD dołączono literę zgodnie z kolejnością wykrycia przyczynowej mutacji genetycznej. Gdy ustalono LGMD2Z, pojawiło się pytanie, jaką literę przypisać kolejnemu odkrytemu LGMD2. Między innymi z tej kwestii ENMC ustanowiła nowy konsensus w sprawie klasyfikacji i definicji LGMD w 2017 r. Wraz z nową definicją z kategorii LGMD usunięto kilka chorób:
| Bieżące imię | Stara nazwa | OMIM | Gen | Umiejscowienie | Powód wykluczenia |
|---|---|---|---|---|---|
| Miopatia miofibrylarna | LGMD1A | 159000 | TTID | Osłabienie dystalne | |
| Dystrofia mięśniowa Emery'ego-Dreifussa (EDMD) | LGMD1B | 159001 | LMNA | Fenotyp EDMD i znaczące zajęcie serca | |
| Falująca choroba mięśni | LGMD1C | 607801 | CAV3 | Charakteryzuje się głównie falowaniem mięśni i bólem | |
| Miopatia miofibrylarna | LGMD1E | 601419 | DES | Osłabienie dystalne i znaczne zajęcie serca | |
| Nie potwierdzone | LGMD1H | 613530 | 3p25.1–s23 | Nadal nie ustalono jako choroby |
Badania
Prowadzonych jest wiele badań ukierunkowanych na różne formy dystrofii mięśniowej kończyn dolnych. Wśród terapii uważanych za obiecujące jest terapia genowa, która polega na dostarczaniu materiału genetycznego, często kopii zdrowego genu, do komórek.
Według przeglądu Bengtssona i in. pewne sukcesy z terapiami genowymi, w których pośredniczy AAV (dla różnych zaburzeń), zwiększyły zainteresowanie naukowców, a CRISPR / Cas9 i pomijanie eksonów pomagają osiągnąć cele terapeutyczne. Dystrofie mięśniowe kończyn i obręczy mają wiele różnych typów, które są spowodowane różnymi mutacjami genów. LGMD2D jest spowodowane mutacją w genie α-sarkoglikanu. Przyszłe leczenie można uzyskać za pomocą terapii genowej za pomocą rekombinowanych wektorów związanych z adenowirusami .
Według przeglądu przeprowadzonego przez Strauba i wsp. istnieje kilka problemów badawczych, którymi należy się zająć: rzadkość występowania choroby, słabe zrozumienie mechanizmu LGMD R oraz brak kohort pacjentów, a wszystko to przyczynia się do braku biomarkerów dla LGMD. W dalszej części przeglądu stwierdza się, że modele zwierzęce LGMD R zostały wykorzystane do analizy leków terapeutycznych. Ponadto, chociaż prednizon był stosowany i miał pozytywny wpływ na osoby dotknięte LGMD2, nadal nie ma dowodów na jego skuteczność w badaniach kontrolowanych placebo.
Zobacz też
Dalsza lektura
- Cotta, Ana; Carvalho, Elmano; da-Cunha-Júnior, Antonio Lopes; Paim, Júlia Filardi; Navarro, Monica M.; Valicek, Jaquelin; Menezes, Miriam Melo; Nunes, Simone Vilela; Xavier Neto, Rafael (2014). „Wspólna recesywna dystrofia mięśniowa obręczy kończyny – diagnostyka różnicowa: dlaczego i jak?” . Arquivos de Neuro-Psiquiatria . 72 (9): 721–734. doi : 10.1590/0004-282X20140110 . ISSN 0004-282X . PMID 25252238 .
- Liu, Jian; Harper, Scott Q. (2012-08-01). „Terapia genowa oparta na RNAi w przypadku dystrofii mięśni obręczy kończyny dominującej” . Obecna terapia genowa . 12 (4): 307–314. doi : 10.2174/156652312802083585 . ISSN 1566-5232 . PMC 4120526 . PMID 22856606 .
- ANGELINI, CORRADO; TASCA, ELISABETTA; NASCIMBENI, ANNA CHIARA; FANIN, MARINA (2014-12-01). „Zmęczenie mięśni, nNOS i zanik włókien mięśniowych w dystrofii mięśniowej obręczy kończyny” . Acta Myologica . 33 (3): 119–126. ISSN 1128-2460 . PMC 4369848 . PMID 25873780 .