Rodzinna polipowatość gruczolakowata
| Rodzinna polipowatość gruczolakowata | |
|---|---|
| Inne nazwy | FAP |
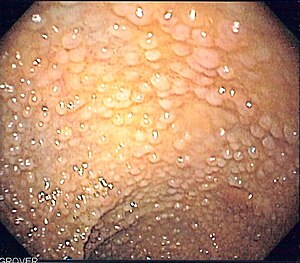 | |
| Obraz endoskopowy esicy u pacjenta z rodzinną polipowatością gruczolakowatą | |
| Specjalność | Gastroenterologia , Onkologia |
| Komplikacje | Rak jelita grubego |
| Zwykły początek | <35 lat |
| Czas trwania | Trwający całe życie |
| typy | Klasyczne lub osłabione |
| Powoduje | Mutacja genu APC |
| Metoda diagnostyczna |
Kolonoskopia Badania genetyczne |
| Diagnostyka różnicowa | Zespół Lyncha , polipowatość związana z MUTYH |
| Leczenie |
Kolonoskopia Polipektomia Górna endoskopia Kolektomia |
| Częstotliwość | 1 na 10 000 - 15 000 |
Rodzinna polipowatość gruczolakowata ( FAP ) jest chorobą dziedziczną autosomalnie dominująco , w której liczne polipy gruczolakowate tworzą się głównie w nabłonku jelita grubego . Podczas gdy te polipy na początku są łagodne , złośliwa transformacja w raka okrężnicy następuje, gdy nie są leczone. Wiadomo, że istnieją trzy warianty, FAP i atenuowany FAP (pierwotnie nazywany zespołem dziedzicznego gruczolaka płaskiego ) są spowodowane defektami genu APC na chromosomie 5, podczas gdy autosomalny recesywny FAP (lub polipowatość związana z MUTYH ) jest spowodowany defektami w genie MUTYH na chromosomie 1 Spośród tych trzech, sam FAP jest najpoważniejszy i najczęstszy; chociaż dla wszystkich trzech powstały polipy okrężnicy i nowotwory są początkowo ograniczone do ściany okrężnicy. Wykrycie i usunięcie przed przerzutami poza okrężnicą może znacznie ograniczyć, aw wielu przypadkach wyeliminować rozprzestrzenianie się raka.
Uważa się, że pierwotną przyczyną FAP jest mutacja genetyczna — zmiana genów supresorowych w organizmie , które zapobiegają rozwojowi nowotworów. Zmiana pozwala wielu komórkom ściany jelita rozwinąć się w potencjalnie rakowe polipy, kiedy zwykle osiągnęłyby koniec swojego życia; nieuchronnie jeden lub więcej z nich ostatecznie rozwinie się i doprowadzi do raka (ryzyko 7% w wieku 21 lat, wzrasta do 87% w wieku 45 lat i 93% w wieku 50 lat). Te zmiany genów nie wywołują raka, ale raczej zmniejszają zdolność organizmu do zapobiegania rakowi komórek. Nawet po zmianie genu może minąć trochę czasu, zanim komórka faktycznie rozwinie się, co w rezultacie zmieni się w nowotworową, a gen może w niektórych przypadkach nadal częściowo działać w celu kontrolowania guzów, dlatego rak z FAP rozwija się przez wiele lat i jest prawie zawsze choroba rozpoczynająca się w wieku dorosłym.
Druga postać FAP, znana jako atenuowana rodzinna polipowatość gruczolakowata, ma funkcjonalny, ale nieznacznie upośledzony gen APC. W związku z tym jest w stanie działać jak zwykle. Atenuowany FAP nadal wiąże się z wysokim 70% ryzykiem zachorowania na raka w ciągu całego życia (jak oszacowano), ale zwykle objawia się znacznie mniejszą liczbą polipów (zwykle 30) niż setkami lub tysiącami, które zwykle występują w FAP, i pojawia się w wieku, w którym FAP zwykle już nie występuje uważane za prawdopodobne - zwykle w wieku od 40 do 70 lat (średnio 55), a nie bardziej typowych 30-latków wzwyż. Ponieważ ma znacznie mniej polipów, opcje zarządzania mogą być różne.
Trzeci wariant, autosomalna recesywna rodzinna polipowatość gruczolakowata lub polipowatość związana z MUTYH , jest również łagodniejsza i, jak sama nazwa wskazuje, wymaga, aby oboje rodzice byli „nosicielami”, aby zamanifestować stan.
W niektórych przypadkach FAP może objawiać się częściej w okrężnicy niż zwykle (na przykład w okrężnicy wstępującej [ potrzebne źródło ] lub proksymalnie do zgięcia śledziony lub w żołądku lub dwunastnicy), gdzie nie daje żadnych objawów, dopóki rak nie jest obecny i znacznie zaawansowany . Mutacje APC powiązano z niektórymi innymi nowotworami, takimi jak rak tarczycy . Ponieważ mutacja powodująca FAP jest autosomalna dominująca, może być dziedziczona bezpośrednio od jednego z rodziców na dziecko. genetyczne badanie krwi genu APC, które może określić, czy jest on obecny, a zatem może przewidzieć możliwość wystąpienia FAP. Osobom zagrożonym (z powodu powiązań rodzinnych lub badań genetycznych) zwykle proponuje się rutynowe monitorowanie przewodu pokarmowego co 1–3 lata przez całe życie, od okresu dojrzewania w przypadku FAP do wczesnej dorosłości w przypadku postaci atenuowanych. Operacja resekcji jelita grubego jest zalecana w przypadku stwierdzenia licznych polipów jelita grubego ze względu na wysokie ryzyko przedwczesnej śmierci z powodu raka jelita grubego. Istnieją międzynarodowe rejestry polipowatości, które śledzą znane przypadki defektów genów FAP lub APC do celów badawczych i klinicznych. Mutacja APC występuje również często w incydentalnych przypadkach raka jelita grubego, co podkreśla jej znaczenie w tej postaci raka.
Symptomy i objawy
Od wczesnej młodości u pacjentów z tym schorzeniem stopniowo (i przez większość czasu bezobjawowo) rozwijają się setki do tysięcy polipów jelita grubego (a czasami polipów w innych miejscach ) — małe nieprawidłowości na powierzchni przewodu pokarmowego , zwłaszcza w jelicie grubym , w tym okrężnicy i odbytnica . Mogą one krwawić, prowadząc do krwi w stolcu. Jeśli krew nie jest widoczna, nadal istnieje możliwość wystąpienia u pacjenta niedokrwistości z powodu stopniowo rozwijającego się niedoboru żelaza. Jeśli rozwinie się nowotwór, może to objawiać się utratą masy ciała , zmienionym rytmem wypróżnień, a nawet przerzutami do wątroby lub innych miejsc. U niektórych osób FAP może również rozwijać się „po cichu”, dając niewiele objawów lub nie dając żadnych objawów, dopóki nie rozwinie się w zaawansowanego raka jelita grubego . [ potrzebne źródło ]
Ponieważ rodzinna polipowatość rozwija się bardzo stopniowo przez lata i może objawiać się w postaci „osłabionej” jeszcze bardziej stopniowo, polipy powstałe w wyniku FAP mogą prowadzić do rozwoju raka w dowolnym momencie, od okresu dojrzewania do starości. [ potrzebne źródło ]
W zależności od natury defektu w genie APC oraz od tego, czy jest to postać pełna, czy atenuowana, polipowatość rodzinna może objawiać się jako polipy w okrężnicy lub w przewodzie dwunastniczym lub w dowolnej ich kombinacji. Dlatego brak polipów, na przykład w odbytnicy, może sam w sobie nie wystarczyć do potwierdzenia braku polipów. Może być konieczne rozważenie i wizualne zbadanie innych możliwych części przewodu pokarmowego. preferowana jest kolonoskopia zamiast sigmoidoskopii , ponieważ zapewnia ona lepszą obserwację wspólnej lokalizacji polipów po prawej stronie.
Determinant genetyczny w polipowatości rodzinnej może również predysponować nosicieli do innych nowotworów złośliwych, np. dwunastnicy i żołądka (zwłaszcza gruczolakoraka ampułkowego). Inne objawy, które mogą wskazywać na FAP, to rozwój włókniaków Gardnera i guzów desmoidalnych (łagodne guzy skóry, które mogą być widoczne przed innymi objawami FAP), zmiany barwnikowe siatkówki ( „CHRPE — wrodzony przerost nabłonka barwnikowego siatkówki”), torbiele szczęki, torbiele łojowe i kostniaki (łagodne guzy kości). Połączenie polipowatości, kostniaków, włókniaków i torbieli łojowych określa się mianem zespołu Gardnera (z lub bez nieprawidłowych blizn).
Genetyka
Rodzinna polipowatość gruczolakowata może mieć różne wzorce dziedziczenia i różne przyczyny genetyczne. Kiedy ten stan wynika z mutacji w genie APC , jest dziedziczony autosomalnie dominująco , co oznacza, że jedna kopia zmienionego genu jest wystarczająca do wywołania zaburzenia. Częstość występowania nowotworów złośliwych w tych przypadkach zbliża się do 100%. W większości przypadków osoba dotknięta chorobą ma jednego rodzica z tą chorobą. [ potrzebne źródło ]
Warianty mutacji genu APC
APC jest genem supresorowym guza odpowiedzialnym za wytwarzanie gruczolakowatej polipowatości jelita grubego (APC), dużego , wielofunkcyjnego białka hamującego nowotwory, które działa jako „strażnik” zapobiegający rozwojowi nowotworów. (APC reguluje β-kateninę , białko, które odgrywa kluczową rolę w komunikacji komórkowej, sygnalizacji, wzroście i kontrolowanym niszczeniu, ale które pozostawione bez kontroli powoduje również liczne nowotwory ). Wada genu APC oznacza, że APC nie jest tak skuteczny, jak powinien, iz biegiem czasu jest prawdopodobne, że niektóre komórki, które powinny być kontrolowane przez APC, nie będą, a zamiast tego będą się rozwijać i stawać się nowotworowe. W znanej polipowatości zwykle objawiają się jako polipy — małe nieprawidłowości na powierzchni przewodu pokarmowego . [ potrzebne źródło ]
Chociaż polipy są z natury łagodne, pierwszy krok hipotezy dwóch trafień już miał miejsce: odziedziczona mutacja APC. Często pozostały „normalny” allel jest zmutowany lub usunięty, co przyspiesza powstawanie polipów. Dalsze mutacje (np. w p53 lub kRAS ) w komórkach z mutacją APC znacznie częściej prowadzą do raka niż w niezmutowanych komórkach nabłonkowych . [ potrzebne źródło ]
Normalna funkcja produktu genu APC jest nadal badana; jest obecny zarówno w jądrze komórkowym , jak iw błonie. Kanoniczną funkcją APC jako supresorem nowotworu jest supresja β-kateniny, ale inne funkcje APC jako supresor nowotworu mogą być związane z przyleganiem komórek i cytoszkieletu .
Mutacja APC występuje również często w incydentalnych przypadkach raka jelita grubego, co podkreśla jej znaczenie w tej postaci raka.
Warianty mutacji genu MUTYH
MUTYH koduje enzym naprawczy DNA glikozylazę MYH. Podczas normalnej aktywności komórkowej guanina czasami zmienia się pod wpływem tlenu , co powoduje, że łączy się w parę z adeniną zamiast cytozyny . Glikozylaza MYH naprawia te błędy poprzez naprawę przez wycinanie zasad , tak że mutacje nie gromadzą się w DNA i nie prowadzą do powstania nowotworu. Gdy glikozylaza MYH nie działa prawidłowo, mogą pojawić się błędy DNA, które zainicjują powstawanie nowotworów z obrazem klinicznym podobnym do tego u pacjentów z mutacjami APC. [ potrzebne źródło ]
Mutacje w genie MUTYH są dziedziczone w sposób autosomalny recesywny , co oznacza, że dwie kopie genu muszą zostać zmienione, aby osoba została dotknięta chorobą. Najczęściej rodzice dziecka z autosomalnym recesywnym zaburzeniem nie są dotknięci chorobą, ale są nosicielami jednej kopii zmienionego genu.
Modele zwierzęce
„ Apc Min ” został opisany w 1990 r. i zawiera allel Apc z kodonem stop w pozycji 850. Heterozygotyczność tej mutacji daje w pełni penetrujący fenotyp na większości środowisk genetycznych, przy czym myszy na wrażliwym tle rozwijają ponad 100 guzów w przewód pokarmowy. Liczba i lokalizacja guzów jelita są modyfikowane przez niezwiązane geny. Od tego czasu pojawiło się wiele innych modeli, w tym model atenuowanego FAP (model 1638N) i kilka warunkowych mutantów, które pozwalają na specyficzną tkankowo lub czasową ablację funkcji genów. Więcej informacji można znaleźć w mysich modelach raka jelita grubego i odbytnicy . [ potrzebne źródło ]
W 2007 r. wyizolowano szczurzy model „ApcPirc” z kodonem stop w pozycji 1137. W przeciwieństwie do modeli mysich, w których >90% guzów tworzy się w jelicie cienkim, szczur Pirc preferencyjnie tworzy nowotwory (>60%) w jelicie cienkim jelita grubego, podobnie jak u ludzi.
Diagnoza
Postawienie diagnozy FAP przed rozwojem raka jelita grubego jest ważne nie tylko dla danej osoby, ale także dla innych członków rodziny, których może dotyczyć. Istnieją dwie metody diagnostyczne: [ potrzebne źródło ]
- Kolonoskopia jest typowym badaniem diagnostycznym z wyboru, ponieważ pozwala lepiej zlokalizować polip po prawej stronie niż sigmoidoskopia, jeśli mutacja jest atenuowana w FAP, i może potwierdzić lub pozwolić na (a) rzeczywisty obraz kliniczny i wszelkie zmiany stanu, osobnika „zagrożonego”, (b) ilościowe oznaczenie polipów w okrężnicy, (c) rozpoznanie histologiczne (wykrywanie komórek/rodzaju raka) oraz (d) w przypadku obecności polipów może zasugerować, czy wycięcie (usunięcie) w warunkach ambulatoryjnych jest wykonalne, czy operacja jest polecany. Aby zasugerować rozpoznanie FAP, można również zastosować lewatywę z baru i wirtualną kolonoskopię (forma obrazowania medycznego).
- Testy genetyczne zapewniają ostateczną diagnozę w 95% przypadków; poradnictwo genetyczne jest zwykle potrzebne w rodzinach, w których zdiagnozowano FAP. Testowanie może również pomóc w diagnozowaniu przypadków granicznych w rodzinach, o których wiadomo, że p34.3 i p32.1 (1p34.3 – p32.1). Testy mogą jedynie wykazać, czy dana osoba jest podatna na FAP lub ją wykluczyć (tj. czy odziedziczyła wadliwy gen APC). Nie może określić faktycznego stanu pacjenta; można to stwierdzić jedynie poprzez bezpośrednie badanie fizykalne.
NCBI stwierdza, że lekarze muszą upewnić się, że rozumieją „ryzyko, korzyści i ograniczenia” każdego testu genetycznego przeprowadzonego od 1997 r. „W przypadku prawie jednej trzeciej osób ocenianych pod kątem FAP lekarz błędnie zinterpretował wyniki testu”.
Po ustaleniu rozpoznania FAP wymagany jest ścisły nadzór kolonoskopowy z polipektomią .
Badania prenatalne są możliwe, jeśli u chorego członka rodziny zostanie zidentyfikowana mutacja powodująca chorobę; jednak badania prenatalne w kierunku typowych zaburzeń występujących w wieku dorosłym są rzadkie i wymagają starannego poradnictwa genetycznego .
USG jamy brzusznej i badania krwi oceniające czynność wątroby , aby wykluczyć przerzuty do wątroby.
Kierownictwo

Ze względu na sposób, w jaki rozwija się rodzinna polipowatość, możliwe jest posiadanie choroby genetycznej, a zatem ryzyko, ale jak dotąd nie ma polipów ani problemów. Dlatego osoba może zostać zdiagnozowana jako „zagrożona” FAP i wymagać rutynowego monitorowania, ale (jeszcze) faktycznie nie ma FAP (tj. nosi wadliwy gen, ale jak dotąd wydaje się, że nie ma żadnych rzeczywistych problemów medycznych w wyniku tego ). Zarządzanie kliniczne może obejmować kilka obszarów: [ potrzebne źródło ]
- Identyfikacja osób, które mogą być narażone na FAP: zwykle na podstawie wywiadu rodzinnego lub badań genetycznych
- Diagnoza (potwierdzająca, czy mają FAP) — można to zrobić za pomocą testów genetycznych, które są ostateczne lub wizualnie sprawdzając sam przewód pokarmowy.
- Należy zauważyć, że badanie wizualne lub monitorowanie nie może „oczyścić” osoby z ryzyka. Można jedynie powiedzieć, jaki jest ich stan w tym czasie. Jeśli w jakimkolwiek momencie życia u danej osoby rozwinie się wiele polipów, może to sugerować diagnozę FAP. (Brak polipów nie „oczyszcza” osoby, ponieważ polipy mogą rozwinąć się w późniejszym życiu; również kilka polipów w czasie nie jest rzadkością u osób bez FAP. Jednak znaczna liczba lub obfitość polipów na ogół sugeruje diagnostyka FAP i badanie histopatologiczne w celu ustalenia, czy polipy są nowotworowe).
- Programy przesiewowe/monitorujące obejmują wizualne badanie przewodu pokarmowego w celu sprawdzenia jego zdrowego stanu. Jest przeprowadzany rutynowo co kilka lat, gdy istnieje powód do niepokoju, gdy (a) test genetyczny potwierdził ryzyko lub (b) test genetyczny nie został przeprowadzony z jakiegokolwiek powodu, więc rzeczywiste ryzyko jest nieznane. Badania przesiewowe i monitorowanie umożliwiają wizualne wykrycie polipowatości, zanim stanie się ona zagrożeniem dla życia.
- Leczenie, zazwyczaj pewnego rodzaju operacja, jest stosowane, jeśli polipowatość doprowadziła do dużej liczby polipów lub znacznego ryzyka zachorowania na raka lub rzeczywistego raka.
Historia rodzinna
NCBI stwierdza, że „Chociaż większość osób, u których zdiagnozowano polipowatość związaną z APC, ma chorego rodzica, historia rodzinna może wydawać się negatywna z powodu nierozpoznania zaburzenia u członków rodziny, przedwczesnej śmierci rodzica przed wystąpieniem objawów, lub późny początek choroby u chorego rodzica”. Ponadto około 20% przypadków to de novo , a wśród osób z pozorną mutacją APC de novo (tj. bez znanej historii rodzinnej) 20% ma mozaicyzm somatyczny . Wiadomo również, że istnieją osoby bezobjawowe (a zatem bezobjawowi członkowie rodziny).
Monitorowanie
Monitorowanie obejmuje zapewnienie ambulatoryjnej kolonoskopii i czasami esophagogastroduodenoskopii górnego odcinka żołądka (EGD, w celu wykrycia przednowotworowych raków żołądka lub dwunastnicy ), zwykle raz na 1–3 lata i / lub genetycznego badania krwi w celu ostatecznego potwierdzenia lub zaprzeczenia wrażliwości. Niewielką liczbę polipów można często wyciąć (usunąć) podczas zabiegu, jeśli zostaną znalezione, ale jeśli występują poważniejsze objawy lub liczby, może być wymagana operacja szpitalna. [ potrzebne źródło ]
NCBI stwierdza, że w przypadku zidentyfikowania osobnika z FAP lub mutacjami prowadzącymi do FAP: „Należy ocenić rodziców chorego osobnika (a) za pomocą molekularnych badań genetycznych w kierunku APC, jeśli mutacja powodująca chorobę jest znana w proband [osoba po raz pierwszy zidentyfikowana z tym schorzeniem] lub (b) w przypadku klinicznych objawów polipowatości związanej z APC”.
Leczenie
Leczenie FAP zależy od genotypu . U większości osób z mutacją APC rozwinie się rak okrężnicy w wieku 40 lat, chociaż mniej powszechna wersja atenuowana zwykle objawia się w późniejszym życiu (40–70). W związku z tym w wielu przypadkach profilaktyczna operacja może być zalecana przed 25 rokiem życia lub po wykryciu choroby, jeśli jest aktywnie monitorowana. Istnieje kilka opcji chirurgicznych, które obejmują usunięcie okrężnicy lub okrężnicy i odbytnicy.
- Zajęta odbytnica: usuwa się odbytnicę i część lub całość okrężnicy. Pacjent może wymagać ileostomii (stała stomia , w której stolec przechodzi do worka na brzuchu) lub rekonstrukcji worka krętniczo-odbytniczego . Decyzja o usunięciu odbytnicy zależy od liczby polipów w odbytnicy oraz wywiadu rodzinnego. Jeśli w odbytnicy występuje niewiele polipów, okrężnicę usuwa się częściowo lub całkowicie, a zamiast tego można bezpośrednio połączyć jelito cienkie (jelito kręte) z odbytnicą (zespolenie krętniczo-odbytnicze).
- Niezajęta odbytnica: część jelita grubego z polipami można usunąć, a końce „ponownie połączyć” ( częściowa kolektomia ), operacja, która ma znaczny czas gojenia, ale pozostawia jakość życia w dużej mierze nienaruszoną.
Profilaktyczna kolektomia jest wskazana, jeśli obecnych jest więcej niż sto polipów, jeśli występują polipy o znacznej dysplastyce lub jeśli występuje wiele polipów większych niż 1 cm.
Leczenie dwóch łagodniejszych postaci FAP może znacznie różnić się od bardziej powszechnego wariantu, ponieważ liczba polipów jest znacznie mniejsza, co daje więcej opcji.
Różne leki są badane pod kątem spowolnienia złośliwej degeneracji polipów, przede wszystkim niesteroidowe leki przeciwzapalne (NLPZ). Wykazano, że NLPZ znacznie zmniejszają liczbę polipów, ale zwykle nie zmieniają postępowania, ponieważ wciąż jest zbyt wiele polipów, aby można je było obserwować i leczyć endoskopowo. Lek eflornityna , inhibitor dekarboksylazy ornityny zwykle stosowany w leczeniu trypanosomatozy , jest badany jako potencjalny lek zapobiegawczy w połączeniu z celekoksybem z NLPZ w leczeniu FAP. Innym badanym środkiem jest sulindak , stosowany również w połączeniu z NLPZ.
Rokowanie
Przed osiągnięciem zaawansowanego stadium raka jelita grubego polipy ograniczają się do wewnętrznej ściany i grubości przewodu pokarmowego i nie dają przerzutów ani „rozprzestrzeniania się”. Tak więc, pod warunkiem wykrycia i kontroli FAP na etapie przednowotworowym lub gdy jakiekolwiek polipy rakowe nadal znajdują się w przewodzie pokarmowym, operacja ma bardzo wysoki wskaźnik skuteczności w zapobieganiu lub usuwaniu raka, bez nawrotów, ponieważ miejsca, w których powstaje rak są fizycznie usuwane w toto przez operację. [ potrzebne źródło ]
wykonano częściową kolektomię , konieczna jest obserwacja kolonoskopii pozostałej części okrężnicy, ponieważ pacjent nadal jest narażony na ryzyko zachorowania na raka okrężnicy. Jednakże, gdyby tak się stało, byłby to raczej świeży incydent z polipami rozwijającymi się na nowo w nieusuniętej części okrężnicy po operacji, niż nawrót lub przerzut jakiegokolwiek nowotworu usuniętego podczas pierwotnej operacji.
Epidemiologia
Częstość występowania mutacji wynosi od 1 na 10 000 do 1 na 15 000 urodzeń. W wieku 35 lat 95% osób z FAP (>100 gruczolaków) ma polipy. Bez kolektomii rak jelita grubego jest praktycznie nieunikniony. Średni wiek zachorowania na raka jelita grubego u osób nieleczonych wynosi 39 lat (zakres 34–43 lat).
Osłabiony FAP pojawia się, gdy APC jest wadliwy, ale nadal w pewnym stopniu funkcjonalny. W rezultacie zachowuje część swojej zdolności do tłumienia polipów. Dlatego atenuowany FAP objawia się jako rak jelita grubego niezwykle późno (wiek 40–70 lat, średnia = 55 lat) i zazwyczaj z nielicznymi lub przynajmniej znacznie mniejszą liczbą polipów (zwykle 30) niż bardziej typowa wersja FAP, w wieku, w którym FAP nie jest już uważane za duże prawdopodobieństwo lub ryzyko zgodnie ze zwykłą epidemiologią FAP.
Porównanie wariantów FAP
Ta tabela porównuje różne podtypy FAP:
| Przedmiot | FAP | Osłabiony FAP | FAP stowarzyszony z MUTYH |
| Gen | APC | APC | MUTYH |
| Typowa manifestacja polipa | Setki / tysiące | Poniżej 100 (0–470, typ. 30), czasami morfologia raczej płaska niż polipowata i bardziej proksymalna od zgięcia śledziony. W badaniu 120 osób 37% (N=44) miało <10 polipów; 3 z tych 44 miało raka jelita grubego]. Obserwuje się również polipy dna żołądka i gruczolaki dwunastnicy. Dlatego polipy i raki mogą objawiać się w górnej części okrężnicy lub górnym odcinku przewodu pokarmowego, a nie w zwykłych lokalizacjach | ? |
| Typowe podstawowe kryteria diagnostyczne | (a) ponad 100 polipów i wiek poniżej 40 lat, LUB (b) polipy i FAP u krewnego | Jeszcze nie rozstrzygnięty. (a) bez historii rodzinnej 100+ polipów przed 30 rokiem życia PLUS JEDEN Z 10-99 polipów / 100+ polipów w wieku powyżej 35 do 40 lat / raka jelita grubego przed 60 rokiem życia i krewni z mnogimi polipami gruczolakowatymi, LUB (b) wywiad rodzinny Od 10 do 99 gruczolaków zdiagnozowanych po 30 roku życia | ? |
| Wiek, w którym pojawiają się polipy | 7–36 (typ. 16), a następnie szybko wzrasta | ? | ? |
| Ryzyko raka jelita grubego ( penetracja ) i wiek, jeśli nie jest leczone | „nieuniknione… praktycznie 100%”: 7% w wieku 21 lat, 87% w wieku 45 lat, 93% w wieku 50 lat. Typowy wiek: 34–43 lata (śr. 39) | „Niższy… mniej znany… szacuje się, że 70% w wieku 80 lat”. Sovaria stwierdza, że w 1998 r. „Średni wiek w momencie rozpoznania CRC wynosi ~ 58 lat” | ? |
| Zmienność | Zmienność fenotypowa między- i wewnątrzrodzinna jest powszechna | Zobacz FAP | ? |
| Możliwe objawy niezwiązane z okrężnicą | „polipy dna żołądka i dwunastnicy, kostniaki, anomalie zębowe, wrodzony przerost nabłonka barwnikowego siatkówki (CHRPE), guzy tkanek miękkich, guzy desmoidalne i nowotwory towarzyszące” | Co do FAP, ale „guzy CHRPE i desmoid są rzadkie”, a także rak tarczycy. | ? |
| Inne zagrożenia życia | „Rak jelita cienkiego [dwunastnicy lub okołobrodawki] 4–12% [dystalnie do dwunastnicy] Rzadko; gruczolakorak trzustki ~ 1%; rak brodawkowaty tarczycy 1–2%; OUN [typ. rdzeniak] <1%; wątrobiak zarodkowy wątroby 1,6%; żółć gruczolakorak przewodów Niski, ale zwiększony; gruczolakorak żołądka <1% w kulturach zachodnich”. | ? | ? |
| Dziedzictwo | „dziedziczone w sposób autosomalny dominujący. Około 75% -80% osób z polipowatością związaną z APC ma chorego rodzica. Potomstwo osoby dotkniętej chorobą ma 50% ryzyko odziedziczenia mutacji powodującej chorobę” | To samo co FAP | Inny — recesywny (wymagane jest, aby dwoje rodziców było nosicielami) |
| Przegląd genetyczny i wykrywanie genetyczne | „Pełne sekwencjonowanie genów wszystkich eksonów APC i granic intron-ekson wydaje się być najdokładniejszym dostępnym testem klinicznym. Większość mutacji APC to mutacje nonsensowne lub mutacje z przesunięciem ramki odczytu, które powodują przedwczesne skrócenie białka APC. Prawdopodobieństwo wykrycia mutacji APC jest wysoce zależy od nasilenia polipowatości okrężnicy i wywiadu rodzinnego. ◦Około 20% osób z widoczną mutacją APC de novo. Markery stosowane do analizy powiązań stanów polipowatości związanych z APC są bardzo pouczające i bardzo ściśle powiązane z locus APC; w związku z tym można ich używać z dokładnością większą niż 98% w ponad 95% rodzin z polipowatością związaną z APC.Badanie powiązań nie jest możliwe w przypadku rodzin z jedną osobą dotkniętą chorobą, co często ma miejsce, gdy osobnik ma mutację genu de novo i nie ma chorego potomstwa. Jeśli nie zostanie wykryta żadna choroba powodująca mutację APC, należy rozważyć molekularne badania genetyczne MUTYH (patrz Diagnostyka różnicowa). | „Oczekuje się, że mniej niż 30% osób z atenuowanymi fenotypami będzie miało możliwą do zidentyfikowania mutację APC” (patrz również szczegóły w części FAP) | ? |
| Genotyp-fenotyp [warunek podstawowy] | Najczęstsza mutacja APC występuje w kodonie 1309 i prowadzi do dużej liczby polipów we wczesnym wieku (~20). Zgłoszono obfitą polipowatość (średnio 5000) z mutacjami w kodonach 1250–1464. Większość częściowych i całych delecji APC jest związana z 100–2000 gruczolaków okrężnicy, chociaż obserwowano atenuowany FAP. Przykładowy typowy wiek zachorowania: między kodonem 168 a 1580 (z wyłączeniem 1309) = 30 lat, 5' kodonu 168 i 3' kodonu 1580 = 52 lata. | Atenuowany FAP jest związany z mutacjami (zwykle skracającymi) w części 5' genu (kodony 1-177), eksonie 9 i dystalnym końcu 3' genu; śródmiąższowe delecje chromosomu 5q22, które obejmują APC; częściowe i całe delecje genów; i mozaicyzm somatyczny dla mutacji APC, które są ogólnie związane z klasycznym FAP. Sovaria twierdzi, że atenuowany FAP jest „spowodowany mutacjami w trzech różnych regionach genu APC - końcu 5 ' w regionie obejmującym eksony 4 i 5, egzon 9 i skrajnym końcu 3' . Ekspresja fenotypowa w tych trzech grupach pokrewieństwa jest zmienna, ale zdecydowanie łagodniejsza niż w klasycznym FAP” oraz że polipy odbytnicy są rzadkie w atenuowanym FAP, ale jeszcze nie potwierdzono, czy oznacza to również mniejsze ryzyko raka odbytnicy. | ? |
| Genotyp–fenotyp [Inne stany poza okrężnicą] | Wyraźne objawy pozaokrężnicze często korelują (choć nie całkowicie) z bardziej dystalnymi mutacjami APC. Ogólne badanie FAP i objawów pozaokrężniczych wykazało, że: mutacje w kodonach 1395-1493 mają znacznie wyższy odsetek guzów desmoidalnych, kostniaków i torbieli naskórkowych niż te z mutacjami w kodonach 177-452; mutacje w kodonach 1395–1493 mają znacznie wyższy odsetek guzów desmoidalnych i kostniaków niż mutacje w kodonach 457–1309; u żadnych osób z mutacjami w kodonach 177–452 nie rozwinęły się kostniaki ani raki okołowierzchołkowe; tylko osoby z mutacjami w kodonach 457–1309 rozwinęły hepatoblastoma i / lub guzy mózgu. Gruczolaki dwunastnicy : Czterokrotnie zwiększone ryzyko z mutacjami między kodonami 976 i 1067. Guzy desmoidalne : mutacje 3' do kodonu 1399 były związane z rozwojem guza desmoidalnego z ilorazem szans 4,37; guzy desmoidalne u 20% osób z mutacjami 5' kodonu 1444, 49% osób z mutacjami 3' kodonu 1444 i 61% osób z mutacjami kodonów 1445-1580; kilka rodzin z ciężkimi guzami desmoidalnymi miało mutacje na skrajnym końcu 3'; spójny związek guzów desmoidalnych z mutacjami dystalnie do kodonu 1444. CHRPE jest związany z: mutacjami między kodonami 311 i 1444; delecje całych genów APC. Rak tarczycy i FAP : U 24 osób większość zidentyfikowanych mutacji dotyczyła 5' kodonu 1220 [Cetta i in. 2000]; U 9 z 12 osób zidentyfikowano mutacje APC w pobliżu regionu klastra mutacji (kodony 1286–1513). Ogólny przegląd literatury (do sierpnia 2006) : ujawnił 89 submikroskopowych delecji APC (42 delecje częściowe i 47 delecji całego genu). Zmiany pozaokrężnicze obserwowano w 36% przypadków, bez znaczących różnic w przypadku delecji częściowych i całych genów. | ? | ? |
| Rozpowszechnienie | „2,29 do 3,2 na 100 000 osób. Polipowatość związana z APC historycznie stanowiła około 0,5% wszystkich raków jelita grubego; liczba ta spada, ponieważ bardziej zagrożeni członkowie rodziny przechodzą skuteczne leczenie po wczesnym wykryciu polipa i profilaktycznej kolektomii”. | „Prawdopodobnie niedodiagnozowany, biorąc pod uwagę mniejszą liczbę polipów okrężnicy i mniejsze ryzyko raka jelita grubego w porównaniu z klasycznym FAP” | ? |
| Leczenie objawów | Klasyczny FAP: „Kolektomia jest zalecana po pojawieniu się gruczolaków; kolektomia może być opóźniona w zależności od wielkości i liczby polipów gruczolakowatych. Kolektomia jest zwykle zalecana, gdy rozwinęło się więcej niż 20 lub 30 gruczolaków lub gruczolaków mnogich o zaawansowanej histologii” | „Kolektomia może być konieczna, ale u około jednej trzeciej osób liczba polipów okrężnicy jest na tyle ograniczona, że wystarczający jest nadzór z okresową polipektomią kolonoskopową” | ? |
| Działania inwigilacyjne (monitorujące) po ustaleniu ryzyka | „Sigmoidoskopia lub kolonoskopia co 1–2 lata, począwszy od wieku 10 do 12 lat; kolonoskopia, gdy wykryto polipy; coroczna kolonoskopia, jeśli kolektomia jest opóźniona o więcej niż rok po pojawieniu się polipów (wiek od 10 do 20 lat z pewnymi łagodniejszymi objawami, można rozważyć opóźnienie kolektomii); przełykowo-gastroduodenoskopia (EGD) w wieku 25 lat lub przed kolektomią i powtarzana co 1–3 lata; w niektórych przypadkach endoskopowa cholangiopankreatografia wsteczna (ERCP) w celu oceny gruczolaków przewodu żółciowego wspólnego; obrazowanie jelita grubego w przypadku wykrycia gruczolaków dwunastnicy lub przed kolektomią, powtarzane co 1–3 lata w zależności od wyników; badanie przesiewowe w kierunku hepatoblastoma (optymalny odstęp czasu nieznany, w jednym opracowaniu zaleca się „co najmniej co trzy miesiące”); coroczne badanie fizykalne, w tym ocena pozajelitowych objawów i badanie palpacyjne tarczycy z uwzględnieniem kontrolnego badania USG i aspiracji cienkoigłowej w przypadku obecności guzków tarczycy” | „Kolonoskopia co dwa do trzech lat, począwszy od wieku 18 do 20 lat; przełykowo-gastroduodenoskopia (EGD) rozpoczynająca się w wieku 25 lat lub przed kolektomią i powtarzana co 1–3 lata; w niektórych przypadkach może być konieczna endoskopowa cholangiopankreatografia wsteczna (ERCP) w celu oceny obecności gruczolaków przewodu żółciowego wspólnego coroczne badanie przedmiotowe z badaniem palpacyjnym tarczycy z rozważeniem kontrolnego badania ultrasonograficznego i aspiracji cienkoigłowej w przypadku obecności guzków tarczycy kolektomia zwykle zalecana przy ponad 20 lub 30 gruczolakach lub gruczolakach mnogich z zaawansowaną histologią rozwinęły się”. Sovaria stwierdza w 1998 r., że „kolonoskopia, w przeciwieństwie do sigmoidoskopii, powinna być zalecana do nadzoru endoskopowego ze względu na umiejscowienie gruczolaków jelita grubego po prawej stronie; nadzór endoskopowy UGI jest uzasadniony w celu wykrycia przednowotworowych guzów żołądka lub dwunastnicy; osoby dotknięte chorobą z [osłabionym FAP] może wymagać całkowitej kolektomii z zespoleniem krętniczo-odbytniczym tylko wtedy, gdy zalecana jest profilaktyczna kolektomia” | ? |
| Decyzja o monitorowaniu | „Wczesne rozpoznanie może pozwolić na szybką interwencję i lepszy końcowy wynik; dlatego też właściwy jest nadzór nad bezobjawowymi dziećmi z grupy ryzyka pod kątem wczesnych objawów; testy genetyczne są bardziej opłacalne niż sigmoidoskopia w określaniu, kto w rodzinie jest dotknięty chorobą; osoby, u których zdiagnozowano APC - polipowatość związana z chorym krewnym ma znacznie dłuższą oczekiwaną długość życia niż osoby zdiagnozowane na podstawie objawów. Badania genetyczne są generalnie oferowane dzieciom zagrożonym klasycznym FAP przed ukończeniem 10. roku życia.Badania genetyczne przy urodzeniu mogą być również uzasadnione, ponieważ niektórzy rodzice i pediatrzy mogą rozważyć badania przesiewowe w kierunku wątrobiaka zarodkowego od niemowlęctwa do wieku 5 lat u chorego potomstwa. optymalny wiek, w którym można rozpocząć badania przesiewowe”. | Zobacz FAP. Również „Badanie przesiewowe okrężnicy u osób z atenuowanym FAP rozpoczyna się w wieku od 18 do 20 lat, dlatego osobom zagrożonym atenuowanym FAP należy zaproponować molekularne badania genetyczne w wieku około 18 lat”. | ? |
| Dziedziczenie i implikacje potwierdzonej diagnozy dla innych bliskich krewnych | Polipowatość związana z APC jest dziedziczona autosomalnie dominująco. Około 20–25% ma zmieniony gen w wyniku mutacji genu de novo. Niewiele lub brak dowodów na stronniczość matki / ojca lub efekt związany z zaawansowanym wiekiem ojca w de novo . Rodzeństwo ma klasyczne 50% ryzyko podzielenia się chorobą, jeśli jest dziedziczone, a nie de novo, oraz „niskie”, ale nieco wyższe ryzyko niż ogólne, jeśli jest de novo , dlatego należy zaoferować badania genetyczne. Każde potomstwo ma 50% szans na dziedziczenie. Inni członkowie rodziny są zagrożeni, jeśli ich rodzice mają tę samą mutację. Mozaicyzm germinalny został udokumentowany w przypadkach bezobjawowych. Testy prenatalne są możliwe dzięki wyekstrahowanemu DNA płodu . | Zobacz FAP | ? |
Rejestry polipowatości
Ze względu na genetyczny charakter FAP, na całym świecie opracowano rejestry polipowatości. Celem tych rejestrów jest zwiększenie wiedzy na temat przenoszenia się FAP, ale także dokumentowanie, śledzenie i powiadamianie członków rodzin osób dotkniętych chorobą. Jedno z badań wykazało, że korzystanie z rejestru w celu powiadamiania członków rodziny (wezwania) znacznie zmniejszyło śmiertelność w porównaniu z probantami . Rejestr polipowatości św. Marka jest najstarszym na świecie, powstał w 1924 r., a obecnie istnieje wiele innych rejestrów polipowatości .
Zobacz też
- Rak jelita grubego
- polip (medycyna)
- gruczolak
- Polipy gruczolakowate
- Polip jelita grubego
- Badania genetyczne
Dalsza lektura
- Jasperson, Kory W.; Patel, Swati G.; Ahnen, Dennis J. (2 lutego 2017). „Warunki polipowatości związane z APC” . W Adamie poseł; Ardinger HH; Pagon RA; Wallace SE (red.). GeneRecenzje . Seattle WA: Uniwersytet Waszyngtoński. PMID 20301519 . NBK1345. — pełne podsumowanie kliniczne FAP i atenuowanego FAP, w tym ryzyko w ciągu całego życia, epidemiologia itp.
- Rodzinna polipowatość gruczolakowata w NLM Genetics Home Reference
- Rodzinna polipowatość gruczolakowata — eMedicine Gastroenterology
- Zespół jelita grubego, polipowatość
- National Cancer Institute: Podsumowanie informacji dotyczących genetyki raka jelita grubego

