Ludzki betaherpeswirus 5
| Ludzki wirus cytomegalii | |
|---|---|
| Specjalność | Choroba zakaźna |
| Powoduje | Ludzki betaherpeswirus 5 |

|
|
| Ludzki betaherpeswirus 5 | |
|---|---|
| CMV zakażenie ludzkiego pneumocytu płuc | |
| Klasyfikacja wirusów | |
| (nierankingowe): | Wirus |
| królestwo : | Duplodnaviria |
| Królestwo: | Heunggongvirae |
| Gromada: | Peploviricota |
| Klasa: | Herviviricetes |
| Zamówienie: | Herpeswirusy |
| Rodzina: | Herpesviridae |
| Rodzaj: | Wirus cytomegalii |
| Gatunek: |
Ludzki betaherpeswirus 5
|
| Synonimy | |
|
|
Ludzki betaherpeswirus 5 , zwany także ludzkim wirusem cytomegalii ( HCMV ), jest gatunkiem wirusa z rodzaju Cytomegalovirus , który z kolei należy do rodziny wirusów znanej jako Herpesviridae lub herpeswirusy. Jest również powszechnie nazywany CMV . W obrębie Herpesviridae HCMV należy do podrodziny Betaherpesvirinae , która obejmuje również wirusy cytomegalii pochodzące od innych ssaków . CMV to wirus o podwójnej nici DNA .
Chociaż można je znaleźć w całym ciele, infekcje HCMV są często związane z gruczołami ślinowymi . Zakażenie HCMV jest zwykle niezauważalne u zdrowych osób, ale może zagrażać życiu osób z obniżoną odpornością , takich jak osoby zakażone wirusem HIV , biorcy narządów lub noworodki . Wrodzona infekcja wirusem cytomegalii może prowadzić do znacznej zachorowalności, a nawet śmierci. Po zakażeniu HCMV pozostaje utajony w organizmie przez całe życie i może zostać reaktywowany w dowolnym momencie. W końcu może to spowodować rak śluzowo-naskórkowy i prawdopodobnie inne nowotwory złośliwe, takie jak rak prostaty i rak piersi .
HCMV występuje we wszystkich lokalizacjach geograficznych i we wszystkich grupach społeczno-ekonomicznych i zaraża od 60% do 70% dorosłych w pierwszym świecie i prawie 100% w trzecim świecie . Ze wszystkich wirusów opryszczki HCMV zawiera najwięcej genów odpowiedzialnych za zmianę (unikanie) wrodzonej i nabytej odporności gospodarza i stanowi trwający całe życie ciężar nadzoru antygenowych komórek T i dysfunkcji układu odpornościowego. Powszechnie wskazuje na to obecność przeciwciał w populacji ogólnej. Seroprewalencja zależy od wieku: 58,9% osób w wieku 6 lat i starszych jest zakażonych CMV, podczas gdy 90,8% osób w wieku 80 lat i starszych jest zakażonych HCMV. HCMV jest również wirusem najczęściej przenoszonym na rozwijający się płód . Zakażenie HCMV jest bardziej rozpowszechnione w krajach rozwijających się oraz w społecznościach o niższym statusie społeczno-ekonomicznym i stanowi najistotniejszą wirusową przyczynę wad wrodzonych w krajach uprzemysłowionych. Wrodzony HCMV jest główną zakaźną przyczyną głuchoty i trudności w uczeniu się i niepełnosprawnością intelektualną u dzieci. CMV również „wydaje się mieć duży wpływ na parametry immunologiczne w późniejszym życiu i może przyczyniać się do zwiększonej zachorowalności i ostatecznej śmiertelności ”.
Symptomy i objawy
ludzkim betaherpeswirusem 5 ma klasyczną triadę objawów: gorączka , osiągająca szczyt późnym popołudniem lub wczesnym wieczorem; zapalenie gardła , zwykle wysiękowe; i symetrycznej adenopatii .
Wirusologia
Przenoszenie
Sposób przenoszenia HCMV z człowieka na człowieka nie jest znany, ale przypuszcza się, że następuje przez płyny ustrojowe, w tym ślinę , mocz , krew i łzy . Cytomegalowirus jest najczęściej przenoszony przez pocałunki i stosunki płciowe. Może być również przeniesiony z zakażonej matki na jej nienarodzone dziecko. Zakażenie wymaga bliskiego, intymnego kontaktu z osobą wydzielającą wirusa w ślinie , moczu lub innych płynach ustrojowych. CMV może być przenoszona drogą płciową i poprzez mleko matki , a także występuje poprzez otrzymywanie przeszczepionych narządów lub transfuzję krwi . Chociaż HCMV nie jest wysoce zaraźliwy, wykazano, że rozprzestrzenia się w gospodarstwach domowych i wśród małych dzieci w ośrodkach opieki dziennej.
Replikacja
HCMV replikuje się w zakażonych komórkach śródbłonka z małą szybkością, trwającą około pięciu dni w hodowli komórkowej . Infekuje również fibroblasty , co wymaga ekspresji tylko trimerycznego kompleksu receptora wirusowego, a nie pełnego kompleksu pentamerycznego, który jest wymagany do zakażenia komórek śródbłonka i nabłonka. Podobnie jak inne herpeswirusy , HCMV wykazuje ekspresję genów w sposób kontrolowany czasowo. Bezpośrednio wczesne geny (0–4 godziny po zakażeniu) biorą udział w regulacji transkrypcji , a następnie wczesne geny (4–48 godzin po zakażeniu), które biorą udział w replikacji wirusowego DNA i dalszej regulacji transkrypcji . Późne geny ulegają ekspresji podczas pozostałej części infekcji, aż do wyjścia wirusa i zazwyczaj kodują białka strukturalne. Podczas gdy HCMV koduje własną funkcjonalną polimerazę DNA , wirus wykorzystuje polimerazę RNA gospodarza do transkrypcji wszystkich swoich genów.
W rozsianych zakażeniach wirusem cytomegalii, jak można zaobserwować w kontekście gospodarza z obniżoną odpornością, wirus łatwo przenosi się między leukocytami polimorfojądrowymi (PM-NL) a komórkami śródbłonka. Zainfekowane komórki śródbłonka wytwarzają cytokiny, które przyciągają PM-NL, które następnie przylegają do śródbłonka przez interakcje między ich integrynami powierzchniowymi komórek zawierającymi CD18 i eksprymowanym w śródbłonku ICAM-1 . Następnie zachodzą mikrofuzje między komórkami w sposób zależny od ekspresji wirusowego locus genu UL128L.
Synteza wirusowego genomu dwuniciowego DNA zachodzi w jądrze komórki gospodarza w wyspecjalizowanych przedziałach replikacji wirusa.
Prawie 75% genów kodowanych przez HCMV szczep AD169 może ulec delecji i nadal prowadzić do produkcji zakaźnego wirusa. Sugeruje to, że wirus koncentruje się na unikaniu układu odpornościowego gospodarza , aby w porę wejść w fazę latencji .
Zagrożone populacje
Zakażenia CMV są najbardziej znaczące w okresie okołoporodowym oraz u osób z obniżoną odpornością.
Ciąża i wrodzona infekcja
HCMV jest jedną z infekcji przenoszonych pionowo , które prowadzą do wad wrodzonych. (Inne to: toksoplazmoza , różyczka i opryszczka zwykła ). Wrodzone zakażenie HCMV występuje, gdy matka ma pierwotną infekcję podczas ciąży.
Do 5 na 1000 żywych urodzeń jest zarażonych. Pięć procent rozwija wiele upośledzeń i rozwija cytomegaliczną chorobę wtrętową z niespecyficznymi objawami przypominającymi różyczkę. Kolejne pięć procent później rozwija się zwapnienie mózgu (dramatycznie obniżające poziom IQ i powodujące głuchotę czuciowo-nerwową i opóźnienie psychomotoryczne). [ potrzebne źródło ]
Jednak niemowlęta urodzone przedwcześnie i zakażone HCMV po urodzeniu mogą w późniejszym życiu doświadczać upośledzeń poznawczych i motorycznych.
Dorośli z obniżoną odpornością
Zakażenie lub reaktywacja CMV u osób, których układ odpornościowy jest osłabiony — na przykład u osób po przeszczepach lub w znacznym stopniu poparzonych — powoduje chorobę i zwiększa ryzyko śmierci.
Reaktywacja CMV jest powszechnie obserwowana u osób z ciężkim zapaleniem jelita grubego .
Określone jednostki chorobowe rozpoznane u tych osób to
- Zapalenie wątroby CMV, które może powodować piorunującą niewydolność wątroby
- cytomegalowirusowe zapalenie siatkówki (zapalenie siatkówki , charakteryzujące się „wyglądem ciasta na pizzę” w oftalmoskopii )
- cytomegalowirusowe zapalenie okrężnicy (zapalenie jelita grubego )
- CMV zapalenie płuc
- CMV zapalenie przełyku
- poliradikulopatia, poprzeczne zapalenie rdzenia kręgowego i podostre zapalenie mózgu
Osoby bez zakażenia CMV, którym przeszczepiono narządy od dawców zakażonych CMV, wymagają profilaktycznego leczenia walgancyklowirem ( najlepiej) lub gancyklowirem oraz regularnego monitorowania serologicznego w celu wykrycia rosnącego miana CMV; w przypadku leczenia można zapobiec wczesnemu powstaniu potencjalnie zagrażającej życiu infekcji.
Osoby dorosłe z prawidłową odpornością
Infekcje CMV mogą nadal mieć znaczenie kliniczne w populacjach dorosłych z prawidłową odpornością.
- Mononukleoza CMV (niektóre źródła rezerwują „mononukleozę” tylko dla wirusa Epsteina-Barra ). Jednak w zespole mononukleozy związanym z CMV zwykle nie występują objawy powiększonych węzłów chłonnych szyjnych i splenomegalii .
- CMV powiązano również z zespołem Guillain-Barré , cukrzycą typu 1 i typu 2.
Dyskutowano nad tym, czy utajona infekcja CMV ma jakikolwiek negatywny wpływ na ludzi, którzy poza tym są zdrowi; od 2016 r. odpowiedź nie była jasna, ale dyskusje koncentrowały się na tym, czy utajona CMV może zwiększać ryzyko niektórych chorób sercowo-naczyniowych i nowotworów .
Patogeneza
Większość zdrowych osób zakażonych HCMV po urodzeniu nie ma żadnych objawów. U niektórych rozwija się zespół podobny do mononukleozy zakaźnej lub gorączki gruczołowej, z przedłużającą się gorączką i łagodnym zapaleniem wątroby . Ból gardła jest powszechny. Po zakażeniu wirus pozostaje w stanie utajonym w limfocytach organizmu do końca życia. Jawna choroba rzadko występuje, chyba że odporność jest tłumiona przez leki, infekcję lub starość. Początkowa infekcja HCMV, która często przebiega bezobjawowo , po którym następuje przedłużona, niewidoczna infekcja, podczas której wirus przebywa w komórkach jednojądrzastych, nie powodując wykrywalnych uszkodzeń ani objawów klinicznych.
Zakaźny wirus CMV może przenikać do płynów ustrojowych każdej zakażonej osoby i można go znaleźć w moczu , ślinie , krwi , łzach , nasieniu i mleku matki . Wysiewanie wirusa może następować sporadycznie, bez żadnych wykrywalnych objawów.
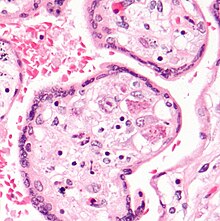
Zakażenie CMV można wykazać mikroskopowo przez wykrycie wewnątrzjądrowych ciałek inkluzyjnych . Podczas barwienia H&E ciałka inkluzyjne zabarwiają się na ciemnoróżowo i nazywane są ciałkami inkluzyjnymi „sowiego oka”.
Zakażenie HCMV jest ważne dla niektórych grup wysokiego ryzyka. Główne obszary ryzyka zakażenia obejmują w okresie prenatalnym lub pourodzeniowym oraz osoby z obniżoną odpornością , takie jak biorcy przeszczepów , osoby z białaczką lub zakażone ludzkim wirusem niedoboru odporności ( HIV ). U osób zakażonych wirusem HIV HCMV uważa się za infekcję definiującą AIDS , co wskazuje, że liczba limfocytów T spadła do niskiego poziomu.
replikujące się litycznie zakłócają cytoszkielet , powodując masowe powiększenie komórek, od czego pochodzi nazwa wirusa.
Badanie opublikowane w 2009 roku łączy infekcję CMV z wysokim ciśnieniem krwi u myszy i sugeruje, że infekcja CMV śródbłonka naczyń krwionośnych u ludzi jest główną przyczyną miażdżycy . Naukowcy odkryli również, że kiedy komórki zostały zakażone CMV, wytworzyły reninę , białko, o którym wiadomo, że przyczynia się do wysokiego ciśnienia krwi.
Ludzka CMV powoduje starzenie się komórek , co może przyczyniać się do przewlekłego stanu zapalnego . Ludzka CMV jest również powiązana z dysfunkcją limfocytów T związaną z wiekiem , przyczyniając się do immunostarzenia . Nasilenie objawów COVID-19 jest związane z CMV, chociaż dokładny mechanizm nie został wyjaśniony.
CMV koduje białko UL16, które bierze udział w unikaniu odpowiedzi immunologicznej komórek NK . Wiąże się z ligandami ULBP1 , ULBP2 i MICB receptora aktywującego komórki NK NKG2D , co zapobiega ich powierzchniowej ekspresji. Te ligandy są normalnie regulowane w górę w czasach stresu komórkowego, takiego jak infekcja wirusowa, a zapobiegając ich regulacji w górę, CMV może zapobiegać śmierci komórki gospodarza z powodu komórek NK
Znaczna część układu odpornościowego jest zaangażowana w ciągłą kontrolę CMV, co wyczerpuje zasoby układu odpornościowego. Śmiertelność z powodu chorób zakaźnych wzrasta wraz z wiekiem, a zakażenie CMV koreluje ze zmniejszoną skutecznością szczepień . Osoby z najwyższymi poziomami przeciwciał przeciwko CMV mają znacznie większe ryzyko zgonu ze wszystkich przyczyn w porównaniu z osobami, które mają niewiele przeciwciał lub nie mają ich wcale.
Diagnoza
Większość infekcji CMV pozostaje niezdiagnozowana, ponieważ wirus zwykle wywołuje niewiele objawów, jeśli w ogóle, i ma tendencję do okresowej reaktywacji bez objawów. Osoby zakażone CMV wytwarzają przeciwciała przeciwko wirusowi, które utrzymują się w organizmie przez całe życie tej osoby. Szereg testów laboratoryjnych wykrywających te przeciwciała przeciwko CMV zostało opracowanych w celu określenia, czy doszło do zakażenia i są one powszechnie dostępne w laboratoriach komercyjnych. Ponadto wirus można hodować z próbek pobranych z moczu, wymazów z gardła, popłuczyn oskrzelowych i próbek tkanek w celu wykrycia aktywnej infekcji. Zarówno jakościowe, jak i ilościowe reakcji łańcuchowej polimerazy (PCR) na CMV, umożliwiające lekarzom monitorowanie miana wirusa u osób zakażonych CMV.
Test antygenemiczny CMV pp65 jest testem opartym na immunofluorescencji, który wykorzystuje technikę immunofluorescencji pośredniej do identyfikacji białka pp65 wirusa cytomegalii w leukocytach krwi obwodowej. Test CMV pp65 jest szeroko stosowany do monitorowania zakażenia CMV i jego odpowiedzi na leczenie przeciwwirusowe u osób, które są w trakcie leczenia immunosupresyjnego i przeszły operację przeszczepu nerki, ponieważ wyniki antygenemii uzyskuje się około 5 dni przed wystąpieniem objawowej choroby CMV. Zaletą tego testu jest szybkość uzyskiwania wyników w ciągu kilku godzin oraz fakt, że oznaczenie antygenu pp65 stanowi przydatne kryterium dla lekarza do rozpoczęcia leczenia przeciwwirusowego. Główną wadą testu pp65 jest to, że na partię testową można przetworzyć tylko ograniczoną liczbę próbek.
CMV należy podejrzewać, jeśli dana osoba ma objawy mononukleozy zakaźnej , ale ma negatywne wyniki testów na mononukleozę i wirusa Epsteina-Barra lub jeśli wykazuje objawy zapalenia wątroby, ale ma negatywne wyniki testów na zapalenie wątroby typu A , B i C.
Aby uzyskać najlepsze wyniki diagnostyczne, należy wykonać testy laboratoryjne na przeciwciała CMV przy użyciu sparowanych próbek surowicy. W przypadku podejrzenia CMV należy pobrać jedną próbkę krwi, a drugą w ciągu 2 tygodni. Hodowlę wirusa można przeprowadzić w dowolnym momencie, gdy osoba ma objawy. Testy laboratoryjne na obecność przeciwciał przeciwko CMV można przeprowadzić w celu ustalenia, czy kobieta miała już zakażenie CMV. Rutynowe badania wszystkich kobiet w ciąży są jednak kosztowne i dlatego należy je oceniać indywidualnie dla każdego przypadku.
Testy serologiczne
Test immunoenzymatyczny (lub ELISA ) jest najczęściej dostępnym testem serologicznym do pomiaru przeciwciał przeciwko CMV. Wynik można wykorzystać do określenia, czy u niemowlęcia występuje ostra infekcja, wcześniejsza infekcja lub biernie nabyte matczyne przeciwciała. Inne testy obejmują różne testy fluorescencyjne, pośrednią hemaglutynację (PCR) i aglutynację lateksową .
technika ELISA dla IgM specyficznych dla CMV , ale może ona dawać wyniki fałszywie dodatnie, chyba że zostaną podjęte kroki w celu usunięcia czynnika reumatoidalnego lub większości przeciwciał IgG przed badaniem próbki surowicy. Ponieważ przeciwciała IgM swoiste dla CMV mogą być wytwarzane na niskim poziomie w reaktywowanym zakażeniu CMV, ich obecność nie zawsze wskazuje na pierwotną infekcję. Tylko wirus odzyskany z narządu docelowego, takiego jak płuco, dostarcza jednoznacznych dowodów na to, że obecna choroba jest spowodowana nabytą infekcją CMV. Jeśli testy serologiczne wykryją dodatnie lub wysokie miano IgG, wynik ten nie powinien być automatycznie interpretowany jako oznaczający obecność aktywnego zakażenia CMV. Aktywne zakażenie CMV uważa się za obecne, jeśli testy na obecność przeciwciał w sparowanych próbkach surowicy wykażą czterokrotny wzrost przeciwciał IgG i znaczny poziom przeciwciał IgM (równy co najmniej 30% wartości IgG) lub jeśli wirus zostanie wyhodowany z moczu lub próbka gardła. [ potrzebne źródło ]
Znaczenie dla dawców krwi
Chociaż ryzyko omówione powyżej jest ogólnie niskie, testy CMV są częścią standardowych badań przesiewowych w przypadku nieukierunkowanego oddawania krwi (dawstwa nieokreślone dla konkretnej osoby) w Stanach Zjednoczonych, Wielkiej Brytanii i wielu innych krajach. Darowizny CMV-ujemne są następnie przeznaczone do transfuzji dla niemowląt lub osób z obniżoną odpornością. Niektóre centra krwiodawstwa prowadzą listy dawców, których krew jest CMV-ujemna ze względu na specjalne wymagania.
Znaczenie dla dawców szpiku kostnego
Podczas allogenicznego przeszczepu hematopoetycznych komórek macierzystych ogólnie zaleca się dopasowanie statusu serologicznego dawcy i biorcy. Jeśli biorca jest seronegatywny, seropozytywny dawca niesie ze sobą ryzyko zakażenia de novo. Odwrotnie, seropozytywny biorca jest narażony na ryzyko reaktywacji wirusa, jeśli otrzyma przeszczep od dawcy seronegatywnego, tracąc przy tym wrodzone mechanizmy obronne. Ogólnie rzecz biorąc, ryzyko jest największe w przypadku seropozytywnych biorców CMV, u których reaktywacja wirusa jest przyczyną znacznej zachorowalności. Z tych powodów testy serologiczne CMV są rutynowe zarówno u dawców, jak i biorców szpiku kostnego.
Zapobieganie
Szczepionka
Badanie fazy 2 szczepionki CMV opublikowane w 2009 roku wykazało skuteczność 50% - zapewniona ochrona była ograniczona, a pewna liczba osób zaraziła się zakażeniem CMV pomimo szczepienia. W jednym przypadku stwierdzono również wrodzoną CMV.
W 2013 roku firma Astellas Pharma rozpoczęła na osobach, które otrzymały przeszczep hematopoetycznych komórek macierzystych, badanie fazy 3 ze szczepionką ASP0113 DNA kwasu dezoksyrybonukleinowego CMV .
W 2015 r. firma Astellas Pharma rozpoczęła na zdrowych ochotnikach badanie fazy 1 szczepionki przeciwko wirusowi cytomegalii ASP0113.
Dalszymi kandydatami na szczepionki przeciwko wirusowi cytomegalii są szczepionka CMV-MVA Triplex i szczepionka peptydowa CMVpp65-A*0201. Obaj kandydaci na szczepionki są sponsorowani przez Narodowe Centrum Medyczne Miasta Nadziei . Od 2016 r. Rozwój jest w fazie badań klinicznych fazy 2.
Higiena
Centra Kontroli i Zapobiegania Chorobom (CDC) zalecają regularne mycie rąk, zwłaszcza po zmianie pieluch. Mycie rąk jest również zalecane po karmieniu dziecka, wycieraniu nosa lub buzi dziecka, czy dotykaniu zabawek dziecięcych.
Leczenie
Globulina hiperimmunizacyjna wzbogacona o CMV (CMV-IGIV) to immunoglobulina G (IgG) zawierająca standaryzowaną liczbę przeciwciał przeciwko wirusowi cytomegalii. Może być stosowany w profilaktyce choroby cytomegalii związanej z przeszczepami nerki, płuc, wątroby, trzustki i serca. Wykazano, że samodzielnie lub w połączeniu ze środkiem przeciwwirusowym:
- Zmniejsz ryzyko choroby i śmierci związanej z wirusem CMV u niektórych biorców przeszczepów z grupy najwyższego ryzyka
- Zapewnij wymierne długoterminowe korzyści w zakresie przeżycia
- Wywołuj minimalne skutki uboczne i zdarzenia niepożądane związane z leczeniem.
gancyklowirem (Cytovene) stosuje się u osób z obniżoną odpornością, u których występują choroby związane ze wzrokiem lub zagrażające życiu. Walgancyklowir (Valcyte) jest lekiem przeciwwirusowym, który jest również skuteczny i podawany doustnie: jest prolekiem, który w organizmie przekształca się w gancyklowir, ale jest znacznie lepiej wchłaniany doustnie niż ten ostatni. Skuteczność terapeutyczna jest często zagrożona przez pojawienie się lekoopornych izolatów wirusa. Donoszono, że różne zmiany aminokwasowe w kinazie białkowej UL97 i wirusowej polimerazie DNA powodują lekooporność. foskarnet lub cydofowir są podawane tylko osobom z wirusem CMV opornym na gancyklowir, ponieważ foskarnet wykazuje znaczną nefrotoksyczność, powodującą zwiększenie lub zmniejszenie poziomu Ca 2+ lub PO 4 3− oraz zmniejszenie poziomu Mg 2+ .
Letermowir został zatwierdzony przez Europejską Agencję Leków i FDA do leczenia i profilaktyki zakażenia HCMV.
Lekooporność
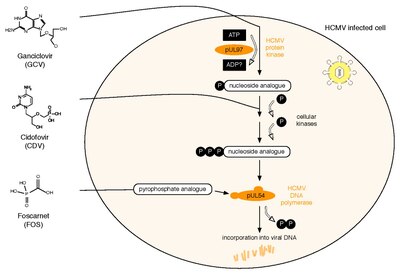
Wszystkie trzy obecnie licencjonowane leki przeciw HCMV są ukierunkowane na wirusową polimerazę DNA , pUL54. Gancyklowir (GCV) działa jako analog nukleozydu. Jego działanie przeciwwirusowe wymaga fosforylacji przez kinazę białkową HCMV, pUL97. Drugi lek, Cidofovir (CDV), jest analogiem nukleotydu, który jest już ufosforylowany, a zatem aktywny. Wreszcie Foscarnet (FOS) ma inny sposób działania. Bezpośrednio hamuje funkcję polimerazy poprzez blokowanie pirofosforanu pUL54 (uwaga: badany lek letermowir działa poprzez mechanizm obejmujący terminazę wirusową). Dwa białka HCMV są zaangażowane w oporność przeciwwirusową na te trzy leki: pUL97 i pUL54. Specyficzne mutacje w pUL97 mogą powodować zmniejszoną aktywność fosforylacji tej wirusowej kinazy białkowej. W ten sposób można zsyntetyzować mniej monofosforylowanych – a zatem aktywnych – GCV, co prowadzi do oporności przeciwwirusowej na GCV. Około 90% wszystkich oporności na GCV jest spowodowanych takimi mutacjami w UL97. Mutacje w pUL54 mogą mieć różne skutki prowadzące do oporności na leki przeciwwirusowe : A. Mogą prowadzić do zmniejszenia powinowactwa do związków przeciwwirusowych. Ten mechanizm oporności dotyczy GCV, CDV i FOS i może prowadzić do oporności wielolekowej. egzonukleazę polimerazy działalność. Powoduje to zwiększone rozpoznawanie włączonych GCV i CDV. W rezultacie te analogi dNTP są wydajniej wycinane. Głównymi czynnikami ryzyka lekooporności HCMV są szczątkowa zdolność układu odpornościowego gospodarza do kontrolowania replikacji wirusa oraz ogólna ilość i czas trwania replikacji wirusa. Oporność HCMV na leki przeciwwirusowe można wykryć za pomocą fenotypowych lub genotypowych testów lekooporności. Badanie oporności fenotypowej obejmuje hodowlę wirusa w hodowli komórkowej i badanie jego wrażliwości przy użyciu różnych stężeń leków przeciwwirusowych w celu określenia EC50 wartości. W przeciwieństwie do tego, testowanie oporności genotypowej oznacza wykrywanie mutacji związanych z opornością w UL97 i UL54 przez sekwencjonowanie . Testy oporności genotypowej stają się metodą z wyboru, ponieważ są szybsze, ale wymagają wcześniejszej charakterystyki fenotypowej każdej nowo odkrytej mutacji. Można to przeprowadzić za pomocą internetowego narzędzia wyszukiwania , które łączy sekwencję HCMV danej osoby z bazą danych zawierającą wszystkie opublikowane mutacje UL97 i UL54 oraz odpowiadające im fenotypy wrażliwości na leki przeciwwirusowe.
Epidemiologia
W Stanach Zjednoczonych zakażenie CMV wzrasta wraz z wiekiem od około 60% osób zakażonych w wieku 6 lat do poziomu około 85–90% populacji w wieku 75–80 lat.
Zobacz też
- Herpesviridae
- Wirus Epsteina-Barra, jeden z najczęstszych wirusów u ludzi.
Linki zewnętrzne
- Ludzki betaherpeswirus 5 w Curlie
- Cytomegalowirus (CMV) Amerykańskie Centra Kontroli i Zapobiegania Chorobom (CDC). 22 maja 2009 r
- Narzędzie mutacji oporności na leki HCMV
- „ Ludzki herpeswirus 5 ” . Przeglądarka taksonomii NCBI . 10359.