Zwyrodnienie plamki żółtej
| Zwyrodnienie plamki żółtej | |
|---|---|
| Inne nazwy | Zwyrodnienie plamki żółtej związane z wiekiem |
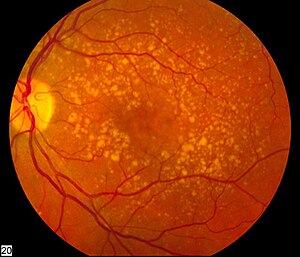 | |
| Zdjęcie tylnej części oka przedstawiające pośrednie zwyrodnienie plamki żółtej związane z wiekiem | |
| Specjalność | Okulistyka , optometria |
| Objawy | Niewyraźne lub brak widzenia w środku pola widzenia |
| Komplikacje | Halucynacje wzrokowe |
| Zwykły początek | Starsi ludzie |
| typy | Wczesna, pośrednia, późna |
| Powoduje | Uszkodzenie plamki żółtej siatkówki |
| Czynniki ryzyka | Genetyka, palenie |
| Metoda diagnostyczna | Badanie wzroku |
| Zapobieganie | Ćwicz, dobrze się odżywiaj, nie pal |
| Leczenie | Leki anty-VEGF wstrzykiwane do oka, koagulacja laserowa , terapia fotodynamiczna |
| Częstotliwość | 8,7% światowego rozpowszechnienia w 2020 r |
Zwyrodnienie plamki żółtej , znane również jako związane z wiekiem zwyrodnienie plamki żółtej ( AMD lub ARMD ), jest stanem chorobowym, który może skutkować niewyraźnym widzeniem lub brakiem widzenia w centrum pola widzenia . Na początku często nie występują żadne objawy. Jednak z biegiem czasu niektórzy ludzie doświadczają stopniowego pogarszania się widzenia, które może dotyczyć jednego lub obu oczu. Chociaż nie powoduje to całkowitej ślepoty , utrata widzenia centralnego może utrudniać rozpoznawanie twarzy, prowadzenie pojazdów, czytanie lub wykonywanie innych czynności życia codziennego. Mogą również wystąpić halucynacje wzrokowe .
Zwyrodnienie plamki żółtej zwykle występuje u osób starszych i jest spowodowane uszkodzeniem plamki żółtej siatkówki . Pewną rolę mogą odgrywać czynniki genetyczne i palenie. Stan jest diagnozowany poprzez pełne badanie wzroku . Nasilenie dzieli się na wczesne, pośrednie i późne. Typ późny dodatkowo dzieli się na formy „suche” i „mokre”, przy czym forma sucha stanowi 90% przypadków.
Różnica między tymi dwiema formami jest klasyfikowana przez zmianę w plamce żółtej. Osoby z suchą postacią AMD mają druzy , szczątki komórkowe w plamce żółtej, które stopniowo uszkadzają komórki wrażliwe na światło i prowadzą do utraty wzroku. W wysiękowej postaci AMD naczynia krwionośne rosną pod plamką, powodując wyciek krwi i płynów do siatkówki.
Ćwiczenia, dobre odżywianie i niepalenie mogą zmniejszyć ryzyko zwyrodnienia plamki żółtej. Nie ma lekarstwa ani leczenia, które przywracałoby już utracony wzrok. W postaci mokrej leki anty-VEGF wstrzykiwane do oka lub, rzadziej, koagulacja laserowa lub terapia fotodynamiczna mogą spowolnić pogorszenie. Dietetyczne witaminy przeciwutleniające , minerały i karotenoidy nie wydają się wpływać na początek. Jednak suplementy diety mogą spowolnić postęp u osób, które już chorują.
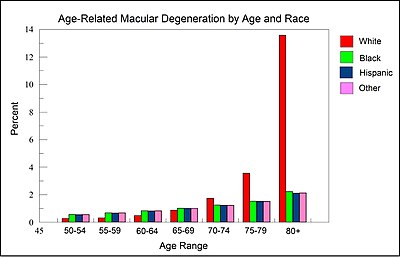
Zwyrodnienie plamki żółtej związane z wiekiem jest główną przyczyną centralnej ślepoty wśród ludności w wieku produkcyjnym na całym świecie. Od 2020 roku dotyka ponad 190 milionów ludzi na całym świecie, a częstość występowania ma wzrosnąć do 288 milionów ludzi do 2040 roku wraz ze wzrostem odsetka osób starszych w populacji. W równym stopniu dotyka mężczyzn i kobiety i częściej występuje u osób pochodzenia europejskiego lub północnoamerykańskiego. W 2013 roku była czwartą najczęstszą przyczyną ślepoty, po zaćmie , porodach przedwczesnych i jaskrze . Najczęściej występuje u osób powyżej pięćdziesiątego roku życia iw Stanach Zjednoczonych jest najczęstszą przyczyną utraty wzroku w tej grupie wiekowej. Około 0,4% osób w wieku od 50 do 60 lat cierpi na tę chorobę, podczas gdy występuje u 0,7% osób w wieku od 60 do 70 lat, 2,3% osób w wieku od 70 do 80 lat i prawie 12% osób w wieku powyżej 80 lat.
Symptomy i objawy
Wczesna lub pośrednia postać AMD może przebiegać bezobjawowo lub objawiać się niewyraźnym lub osłabionym widzeniem w jednym lub obu oczach. Może to początkowo objawiać się trudnościami w czytaniu lub prowadzeniu pojazdu (szczególnie w słabo oświetlonych miejscach). Inne objawy AMD obejmują zniekształcenie widzenia i martwe punkty (szczególnie w centralnym polu widzenia i wokół niego).
Inne oznaki i objawy zwyrodnienia plamki żółtej obejmują:
- Zniekształcone widzenie w postaci metamorfopsji , w której siatka prostych linii wydaje się falista, a części siatki mogą wydawać się puste: Pacjenci często zauważają to po raz pierwszy, patrząc na rzeczy, takie jak mini-żaluzje w domu lub słupy telefoniczne podczas jazdy. Mogą również występować mroczki centralne , cienie lub brakujące obszary widzenia
- Powolny powrót funkcji wzrokowych po ekspozycji na jasne światło ( test fotostresu )
- Drastycznie spadająca ostrość wzroku (dwa poziomy lub więcej), np.: 20/20 do 20/80
- Niewyraźne widzenie: osoby z niewysiękowym (suchym) zwyrodnieniem plamki żółtej mogą nie wykazywać żadnych objawów lub zauważać stopniową utratę widzenia centralnego, podczas gdy osoby z wysiękowym (mokrym) zwyrodnieniem plamki żółtej często zauważają szybki początek utraty wzroku (często spowodowanej wyciekiem i krwawieniem nieprawidłowej krwi) statki).
- Kłopoty z rozróżnianiem kolorów, szczególnie ciemnych od ciemnych i jasnych od jasnych
- Utrata wrażliwości na kontrast
- Powstające halucynacje wzrokowe i migające światła były również związane z poważną utratą wzroku wtórną do wysiękowej postaci AMD
Samo zwyrodnienie plamki żółtej nie prowadzi do całkowitej ślepoty. Jeśli o to chodzi, tylko niewielka liczba osób z wadami wzroku jest całkowicie niewidoma. W prawie wszystkich przypadkach pozostaje część widzenia, głównie peryferyjnego. Inne komplikujące stany mogą prowadzić do takiego stanu ostrego (ciężki udar lub uraz, nieleczona jaskra itp.), ale niewielu pacjentów ze zwyrodnieniem plamki żółtej doświadcza całkowitej utraty wzroku.
Obszar plamki żółtej stanowi zaledwie około 2,1% siatkówki, a pozostałe 97,9% (pole obwodowe) pozostaje niezmienione chorobą. Chociaż plamka zapewnia tak niewielką część pola widzenia, prawie połowa kory wzrokowej jest poświęcona przetwarzaniu informacji plamki.
Ponadto osoby z suchym zwyrodnieniem plamki żółtej często nie odczuwają żadnych objawów, ale mogą stopniowo pojawiać się niewyraźne widzenie w jednym lub obu oczach. Osoby z mokrym zwyrodnieniem plamki żółtej mogą doświadczyć ostrego początku objawów wizualnych.
Czynniki ryzyka
Kluczowymi czynnikami ryzyka są wiek, rasa/pochodzenie etniczne, palenie tytoniu i wywiad rodzinny . Zaawansowany wiek jest najsilniejszym predyktorem AMD, zwłaszcza powyżej 50 roku życia.
Rasa i pochodzenie etniczne
Jak ilustruje rycina w tej sekcji, pochodząca z danych przedstawionych przez National Eye Institute w Stanach Zjednoczonych, wśród osób powyżej 80 roku życia osoby rasy białej są ponad 6-krotnie bardziej narażone na rozwój AMD niż osoby rasy czarnej lub latynoskiej. Tak więc białe tło jest głównym czynnikiem ryzyka AMD.
W skórze kaukaskiej (białej) istnieje specyficzna grupa genów polimorficznych (ze zmianami pojedynczych nukleotydów), które kodują enzymy i czynniki transkrypcyjne odpowiedzialne za wczesne etapy (w tym pierwszy etap, tworzenie L-DOPA z aminokwasu tyrozyny ) szlaku syntezy melaniny . Wiele z tych enzymów i czynników transkrypcyjnych są recenzowane przez Markiewicza i Idowu. Ponadto, zgodnie z przeglądem Sturm et al. „Zwiększenie wewnątrzkomórkowego stężenia tyrozyny lub L-DOPA powoduje wzrost melanogenezy” lub tworzenie czarnego pigmentu melaniny. Wydaje się zatem, że istnieje związek między zmniejszoną produkcją L-DOPA a białą skórą. Jak sugeruje rysunek i informacje w tej sekcji, zmniejszona ilość L-DOPA, prowadząca do białej skóry, wydaje się być związana ze zwiększonym ryzykiem zwyrodnienia plamki żółtej u osób rasy białej w wieku powyżej 80 lat.
Środowisko i styl życia
- Palenie: Palenie tytoniu zwiększa ryzyko wystąpienia AMD dwa do trzech razy w porównaniu z osobą, która nigdy nie paliła, i może być najważniejszym modyfikowalnym czynnikiem w jej zapobieganiu. Przegląd wcześniejszych badań wykazał „silny związek między obecnym paleniem a AMD.… Palenie papierosów może mieć toksyczny wpływ na siatkówkę”.
- Nadciśnienie ( wysokie ciśnienie krwi ): W badaniu ALIENOR 2013 wczesne i późne AMD nie były istotnie związane ze skurczowym lub rozkurczowym ciśnieniem krwi (BP), nadciśnieniem lub stosowaniem leków przeciwnadciśnieniowych, ale z podwyższonym ciśnieniem tętna [(PP) skurczowe BP minus rozkurczowe BP] było istotnie związane ze zwiększonym ryzykiem późnej postaci AMD.
- Miażdżyca tętnic
- Wysoki poziom cholesterolu : Podwyższony poziom cholesterolu może zwiększać ryzyko wystąpienia AMD
- Otyłość: Otyłość brzuszna jest czynnikiem ryzyka, zwłaszcza wśród mężczyzn
- Spożycie tłuszczów: Spożywanie dużych ilości niektórych tłuszczów, w tym tłuszczów nasyconych , tłuszczów trans i kwasów tłuszczowych omega-6 , prawdopodobnie przyczynia się do AMD, podczas gdy tłuszcze jednonienasycone potencjalnie chronią. W szczególności kwasy tłuszczowe omega-3 mogą zmniejszać ryzyko wystąpienia AMD.
- Ekspozycja na promieniowanie UV ze światła słonecznego może być związana ze zwiększonym ryzykiem rozwoju AMD, chociaż dowody są słabsze niż inne przyczyny.
- Cyfrowy ekran nie emituje szkodliwej energii przeciwko ludzkim oczom, ale wpatrywanie się w ekran przez długi czas bez przerw zwiększa zmęczenie oczu . Nie ma dowodów na poparcie twierdzenia, że ekspozycja na ekrany cyfrowe przyczynia się do ryzyka zwyrodnienia plamki żółtej.
Genetyka
AMD jest wysoce dziedziczną chorobą. Współczynniki nawrotów u rodzeństwa osoby dotkniętej chorobą są od trzech do sześciu razy wyższe niż w populacji ogólnej. powiązań genetycznych zidentyfikowała 5 zestawów wariantów genów w trzech lokalizacjach na różnych chromosomach (1, 6 i 10), które wyjaśniają co najmniej 50% ryzyka. Geny te pełnią role regulujące odpowiedź immunologiczną, procesy zapalne i homeostazę siatkówki. Warianty tych genów powodują różnego rodzaju dysfunkcje w tych procesach. Z biegiem czasu powoduje to gromadzenie się wewnątrzkomórkowych i zewnątrzkomórkowych resztek metabolicznych. Może to spowodować bliznowacenie siatkówki lub załamanie jej unaczynienia.
Lista wariacji genetycznych związanych z AMD obejmuje czynniki dopełniacza , apolipoproteinę E , czynnik wzrostu fibroblastów 2 , białko naprawy wycinania DNA i białko podatności na makulopatię związaną z wiekiem 2.
Chociaż testy genetyczne mogą prowadzić do identyfikacji zmienności genetycznej, która może predysponować do AMD, złożona patogeneza choroby uniemożliwia stosowanie tych testów w rutynowej praktyce. Niemniej jednak mogą być przydatne w selekcji pacjentów do badań klinicznych i analizie ich odpowiedzi na leczenie. Wyznaczono trzy loci, w których znaleziono zidentyfikowane warianty genów:
- Czynnik dopełniacza H (CFH) na chromosomie 1 w lokalizacji 1q31.3
- Peptydaza serynowa HTRA 1/Makulopatia związana z wiekiem Podatność na makulopatię 2 (HTRA1/ARMS2) na chromosomie 10 w lokalizacji 10q26
- Czynnik dopełniacza B/składnik dopełniacza 2 (CFB/CC2) na chromosomie 6 w 6p21.3
Konkretne geny
- Polimorfizmy w genach białek układu dopełniacza : Zmienność genów białek układu dopełniacza, między innymi czynnika H (CFH), czynnika B (CFB) i czynnika 3 (C3), jest silnie związana z ryzykiem rozwoju AMD u danej osoby. CFH bierze udział w hamowaniu odpowiedzi zapalnej. Mutacja w CFH ( Y402H ) skutkuje zmniejszoną zdolnością białka do lokalizowania się i ochrony tkanek, takich jak siatkówka, przed nadmierną aktywacją dopełniacza. Brak genów R3 i R1 związanych z czynnikiem dopełniacza H chroni przed AMD. Dwa niezależne badania przeprowadzone w 2007 roku wykazały, że pewna powszechna mutacja Arg80Gly w genie C3, który jest centralnym białkiem układu dopełniacza , jest silnie związana z występowaniem AMD. Autorzy obu prac uważają, że ich badania podkreślają wpływ układu dopełniacza na patogenezę tej choroby.
- zidentyfikowano inny gen, który ma implikacje dla choroby, nazwany HTRA1 (kodujący wydzielaną proteazę serynową).
- Sześć mutacji genu SERPING1 (inhibitor peptydazy serpinowej, klad G (inhibitor C1), członek 1) jest związanych z AMD. Mutacje w tym genie mogą również powodować dziedziczny obrzęk naczynioruchowy .
- Mutacja fibuliny-5 : Rzadkie postacie choroby są spowodowane defektami genetycznymi fibuliny-5, w sposób autosomalny dominujący. W 2004 roku Stone i in. przeprowadzili badanie przesiewowe na 402 pacjentach z AMD i ujawnili statystycznie istotną korelację między mutacjami w fibulinie-5 a częstością występowania choroby.
- Polimorfizmy genów związanych z mitochondriami , takie jak w cząsteczce MT-ND2 , przewidują wysiękową postać AMD.
Patofizjologia
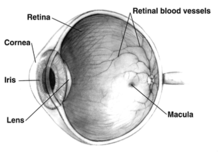
Patogeneza zwyrodnienia plamki żółtej związanego z wiekiem nie jest dobrze poznana, chociaż wysunięto pewne teorie, w tym stres oksydacyjny, dysfunkcję mitochondriów i procesy zapalne.
Brak równowagi między produkcją uszkodzonych składników komórkowych a degradacją prowadzi do gromadzenia się szkodliwych produktów, na przykład wewnątrzkomórkowej lipofuscyny i zewnątrzkomórkowych druz. Początkowa atrofia jest wyznaczana przez obszary nabłonka barwnikowego siatkówki (RPE), które poprzedzają atrofię geograficzną we wczesnych stadiach AMD. W zaawansowanych stadiach AMD zanik RPE (atrofia geograficzna) i/lub rozwój nowych naczyń krwionośnych (neowaskularyzacja) skutkuje obumieraniem fotoreceptorów i utratą widzenia centralnego.
W postaci suchej ( niewysiękowej ) druzy gromadzą się między siatkówką a naczyniówką , powodując atrofię i bliznowacenie siatkówki. W postaci mokrej (wysiękowej), która jest cięższa, naczynia krwionośne wyrastają z naczyniówki (neowaskularyzacja) za siatkówką, co może powodować wyciek wysięku i płynu, a także powodować krwotok.
Wczesne prace wykazały, że rodzina mediatorów immunologicznych była bogata w druzy. Czynnik dopełniacza H (CFH) jest ważnym inhibitorem tej kaskady zapalnej, a polimorfizm związany z chorobą w genie CFH silnie wiąże się z AMD. W ten sposób rozwinięto patofizjologiczny model AMD przewlekłej aktywacji dopełniacza niskiego stopnia i stanu zapalnego w plamce żółtej. Uwiarygodnieniem tego było odkrycie polimorfizmów genetycznych związanych z chorobą w innych elementach kaskady dopełniacza, w tym w składniku 3 dopełniacza (C3).
Potężny predyktor AMD znajduje się na chromosomie 10q26 w LOC 387715. Polimorfizm insercji/delecji w tym miejscu zmniejsza ekspresję genu ARMS2 poprzez destabilizację jego mRNA poprzez delecję sygnału poliadenylacji . Białko ARMS2 może lokalizować się w mitochondriach i uczestniczyć w metabolizmie energetycznym, choć wiele pozostaje do odkrycia na temat jego funkcji.
Inne markery genetyczne ryzyka progresji obejmują tkankowy inhibitor metaloproteinazy 3 ( TIMP3 ), co sugeruje rolę metabolizmu macierzy pozakomórkowej w progresji AMD. Zmiany w genach metabolizujących cholesterol, takich jak lipaza wątrobowa , transferaza estru cholesterolu, lipaza lipoproteinowa i kaseta wiążąca ATP A1 korelują z postępem choroby. Wczesne stygmaty choroby, druzy, są bogate w cholesterol, co zapewnia autentyczność wyników badań asocjacyjnych całego genomu.
Gradacja
W AMD dochodzi do stopniowego gromadzenia się charakterystycznych żółtych złogów, zwanych druzami (nagromadzenie zewnątrzkomórkowych białek i lipidów), w plamce żółtej (część siatkówki), pomiędzy nabłonkiem barwnikowym siatkówki a leżącą pod nią naczyniówką . Uważa się, że ta akumulacja z czasem uszkadza siatkówkę. Amyloid beta , który gromadzi się w chorobie Alzheimera mózgu, jest jednym z białek, które gromadzą się w AMD, co jest powodem, dla którego AMD jest czasami nazywane „Alzheimerem oka” lub „Alzheimerem siatkówki”. AMD można podzielić na 3 stadia: wczesne, pośrednie i późne, częściowo w oparciu o zasięg (wielkość i liczbę) druzów .
Patologia podobna do AMD zaczyna się od małych żółtych złogów ( druzów ) w plamce żółtej, między nabłonkiem barwnikowym siatkówki a leżącą pod nią naczyniówką . Większość osób z tymi wczesnymi zmianami (określanymi jako makulopatia związana z wiekiem) nadal ma dobry wzrok. Osoby z druzami mogą, ale nie muszą, rozwinąć AMD. W rzeczywistości większość osób w wieku powyżej 60 lat ma druzy bez żadnych skutków ubocznych. Ryzyko wystąpienia objawów jest większe, gdy druzy są duże i liczne, i wiąże się z zaburzeniem warstwy komórek barwnikowych pod plamką. Uważa się, że duże i miękkie druzy są spokrewnione z podwyższonymi cholesterolowe .
Wczesne AMD
Wczesne AMD rozpoznaje się na podstawie obecności druz średniej wielkości, mniej więcej szerokości przeciętnego ludzkiego włosa. Wczesna postać AMD jest zwykle bezobjawowa.
AMD średniozaawansowane
Pośrednie AMD rozpoznaje się na podstawie dużych druzów i/lub jakichkolwiek nieprawidłowości barwnikowych siatkówki. Pośrednia postać AMD może powodować pewną utratę wzroku, ale podobnie jak wczesna postać AMD zwykle przebiega bezobjawowo.
Ostatnio zidentyfikowano podgrupy pośredniej postaci AMD, w których występuje bardzo wysokie ryzyko progresji w kierunku późnej postaci AMD. Ta podgrupa (w zależności od dokładnych definicji) jest określana jako rodząca się GA i/lub iRORA (niekompletny nabłonek barwnikowy siatkówki i zanik zewnętrznej części siatkówki). Te podgrupy „wysokiego ryzyka” pośredniego AMD można wykorzystać do informowania pacjentów o ich rokowaniach. Ponadto można je zastosować w badaniach klinicznych jako punkty końcowe.
Późne AMD
W późnym AMD dochodzi do uszkodzenia siatkówki na tyle, że oprócz druzów ludzie zaczną również doświadczać objawowej utraty widzenia centralnego. Uszkodzeniem może być albo rozwój atrofii, albo początek choroby neowaskularnej. Późne AMD dzieli się dalej na dwa podtypy w zależności od rodzaju uszkodzeń: zanik geograficzny i wysiękowe AMD (zwane także wysiękowym AMD).
Suche AMD
Suche AMD (zwane również niewysiękowym AMD) to szerokie określenie, obejmujące wszystkie formy AMD, które nie są neowaskularne (wysiękowe AMD). Obejmuje to wczesną i pośrednią postać AMD, a także zaawansowaną postać suchej postaci AMD, znaną jako atrofia geograficzna. Pacjenci z suchą postacią AMD mają zwykle minimalne objawy we wcześniejszych stadiach; utrata funkcji wzrokowych występuje częściej, jeśli stan przechodzi w atrofię geograficzną. Suche AMD odpowiada za 80–90% przypadków i ma tendencję do powolnego postępu. U 10–20% osób sucha postać AMD przechodzi w postać wysiękową.
Atrofia geograficzna
Atrofia geograficzna (zwana także zanikowym AMD) jest zaawansowaną postacią AMD, w której postępująca i nieodwracalna utrata komórek siatkówki prowadzi do utraty funkcji widzenia. Siatkówka składa się z wielu warstw, aw atrofii geograficznej istnieją trzy specyficzne warstwy, które ulegają atrofii: naczyniówka włosowata, nabłonek barwnikowy siatkówki i leżące nad nią fotoreceptory.
Trzy warstwy, które ulegają atrofii w atrofii geograficznej, sąsiadują ze sobą. Fotoreceptory są najbardziej powierzchowne i są komórkami odpowiedzialnymi za przekształcanie energii ze światła ze świata zewnętrznego w sygnał elektryczny wysyłany do mózgu. Istnieje kilka funkcji nabłonka barwnikowego siatkówki. Jedną z głównych funkcji nabłonka barwnikowego siatkówki jest minimalizacja stresu oksydacyjnego. Czyni to poprzez pochłanianie światła, a tym samym zapobieganie jego przedostawaniu się do leżących poniżej warstw. Warstwy leżące pod nabłonkiem barwnikowym siatkówki są bardzo unaczynione, więc mają bardzo wysokie ciśnienie tlenu. Tak więc, jeśli światło miałoby dostać się do tych warstw, powstałoby wiele wolnych rodników i spowodowałoby uszkodzenie pobliskich tkanek. Najgłębsza warstwa, która ulega atrofii w atrofii geograficznej, nazywa się choriocappilaris. Jest to sieć naczyń włosowatych, która dostarcza składniki odżywcze do nabłonka barwnikowego siatkówki.
Patofizjologia atrofii geograficznej jest nadal niepewna. Niektóre badania kwestionowały, czy było to spowodowane niedoborem nabłonka barwnikowego siatkówki, co prowadzi do zwiększonego stresu oksydacyjnego. W innych badaniach szukano zapalnych przyczyn uszkodzeń. Jak dotąd środowisko medyczne wciąż nie jest pewne. W ostatnich badaniach zaczęto przyglądać się każdej warstwie z osobna. Odkryli, że spadek przepływu krwi w choriocapillaris poprzedza atrofię nabłonka barwnikowego siatkówki i leżących nad nim fotoreceptorów. Ponieważ choriocapillaris jest warstwą naczyniową, można to wykorzystać jako argument przemawiający za tym, dlaczego atrofia geograficzna może być chorobą spowodowaną zmniejszonym przepływem krwi.
Mokre AMD
Wysiękowe lub neowaskularne AMD, „mokra” postać zaawansowanego AMD, powoduje utratę wzroku z powodu nieprawidłowego wzrostu naczyń krwionośnych ( neowaskularyzacja naczyniówkowa ) w naczyniach włosowatych naczyniówki przez błonę Brucha . Zwykle, choć nie zawsze, poprzedza ją sucha postać AMD. Proliferacja nieprawidłowych naczyń krwionośnych w siatkówce jest stymulowana przez czynnik wzrostu śródbłonka naczyniowego (VEGF). Ponieważ te naczynia krwionośne są nieprawidłowe, są one również bardziej kruche niż typowe naczynia krwionośne, co ostatecznie prowadzi do wycieku krwi i białka poniżej plamki żółtej. Krwawienie, wyciek i blizny z tych naczyń krwionośnych ostatecznie powodują nieodwracalne uszkodzenie fotoreceptorów i szybką utratę wzroku, jeśli nie są leczone.
Diagnoza
Rozpoznanie związanego z wiekiem zwyrodnienia plamki żółtej zależy od objawów w plamce żółtej , niekoniecznie wzroku. Wczesna diagnoza AMD może zapobiec dalszemu pogorszeniu widzenia i potencjalnie poprawić widzenie.
Rozpoznanie suchego (lub wczesnego stadium) AMD może obejmować następujące badania kliniczne oraz procedury i testy:
- Przejście od suchej do wysiękowej AMD może nastąpić szybko, a jeśli nie jest leczone, może doprowadzić do prawnej ślepoty w ciągu zaledwie sześciu miesięcy. Aby temu zapobiec i zainicjować strategie zapobiegawcze na wcześniejszym etapie procesu chorobowego, można przeprowadzić testy adaptacyjne do ciemności. Ciemny adaptometr może wykryć subkliniczną postać AMD co najmniej trzy lata wcześniej, niż jest to klinicznie oczywiste.
- Następuje utrata wrażliwości na kontrast, przez co kontury, cienie i widzenie kolorów są mniej żywe. Utratę wrażliwości na kontrast można szybko i łatwo zmierzyć za pomocą wrażliwości na kontrast , takiego jak Pelli Robson, wykonywanego w domu lub przez okulistę.
- Podczas przeglądania siatki Amslera niektóre linie proste wydają się faliste, a niektóre obszary wydają się puste
- Podczas przeglądania wykresu Snellena co najmniej 2 linie opadają
- W suchym zwyrodnieniu plamki żółtej, które występuje w 85–90 procentach przypadków AMD, plamki druzy można zobaczyć na fotografii dna oka
- Za pomocą elektroretinogramu można znaleźć punkty w plamce żółtej ze słabą reakcją lub jej brakiem w porównaniu z normalnym okiem
- Test barwy Farnswortha-Munsella 100 i test maksymalnej czułości kontrastu kolorów (MCCS) do oceny ostrości kolorów i wrażliwości na kontrast kolorów
- Optyczna tomografia koherentna jest obecnie wykorzystywana przez większość okulistów w diagnostyce i dalszej ocenie odpowiedzi na leczenie lekami antyangiogennymi.
Rozpoznanie mokrego (lub późnego stadium) AMD może obejmować następujące testy oprócz powyższych testów:
- Preferencyjne zmiany perymetrii nadwrażliwości (dla wysiękowej postaci AMD). Preferencyjna perymetria nadostrości to test, który wykrywa drastyczne zmiany w widzeniu i obejmuje stymulację plamki żółtej za pomocą zniekształconych wzorów kropek oraz identyfikację pacjenta, gdzie w polu widzenia to następuje.
- W mokrym zwyrodnieniu plamki żółtej angiografia może uwidocznić wyciek krwi za plamką. Angiografia fluoresceinowa pozwala na identyfikację i lokalizację nieprawidłowych procesów naczyniowych.
Histologia
- Zmiany barwnikowe w siatkówce – oprócz komórek barwnikowych w tęczówce (kolorowej części oka) pod siatkówką znajdują się komórki barwnikowe. Gdy te komórki rozpadają się i uwalniają swój pigment, mogą pojawić się ciemne grudki uwolnionego pigmentu, a później obszary mniej pigmentowane
- Zmiany wysiękowe: krwotoki do oka, twarde wysięki, płyn podsiatkówkowy/sub-RPE/śródsiatkówkowy
- Druzy , małe skupiska materiału pozakomórkowego, które gromadzą się na siatkówce. Chociaż istnieje tendencja do obwiniania druzów za postępującą utratę wzroku, złogi druzów mogą być obecne w siatkówce bez utraty wzroku. Niektórzy pacjenci z dużymi złogami druzów mają prawidłową ostrość wzroku. Jeśli normalny odbiór siatkówkowy i transmisja obrazu są czasami możliwe w siatkówce, gdy obecne są wysokie stężenia druzów, to nawet jeśli druzy mogą być zaangażowane w utratę funkcji wzroku, musi istnieć co najmniej jeden inny czynnik, który odpowiada za utratę wizja.
Kierownictwo
Leczenie AMD różni się w zależności od kategorii choroby w momencie rozpoznania. Ogólnie rzecz biorąc, leczenie ma na celu spowolnienie postępu AMD. Od 2018 roku nie ma metod leczenia odwracających skutki AMD. We wczesnym i pośrednim stadium AMD leczy się modyfikując znane czynniki ryzyka, takie jak zaprzestanie palenia tytoniu, leczenie nadciśnienia tętniczego i miażdżycy tętnic oraz wprowadzając modyfikacje diety. W przypadku pośredniego stadium AMD postępowanie obejmuje również suplementację przeciwutleniaczy i minerałów . Postępowanie w zaawansowanym stadium AMD opiera się na obecności neowaskularyzacji naczyniówkowej (CNV): sucha postać AMD (brak obecności CNV) lub wysiękowa postać AMD (obecność CNV). Nie ma skutecznych metod leczenia suchej postaci AMD. CNV obecna w wysiękowej postaci AMD jest leczona inhibitorami czynnika wzrostu śródbłonka naczyniowego ( VEGF ). Codzienne korzystanie z siatki Amslera lub innych domowych narzędzi do monitorowania wzroku może być wykorzystywane do monitorowania rozwoju zniekształconego widzenia, które może być oznaką postępu choroby.
Suplementy diety
Badania 1 i 2 dotyczące chorób oczu związanych z wiekiem ( AREDS ) wykazały, że osoby z obustronną wczesną lub pośrednią postacią AMD lub pośrednią postacią AMD w jednym oku i zaawansowaną postacią AMD w drugim oku mogą odnieść korzyść ze specyficznej suplementacji witaminami i składnikami mineralnymi. Specyficzne witaminy i minerały zawarte w AREDS-1 to witamina C (500 mg), cynk (80 mg), witamina E (400 j.m.), miedź (2 mg) i beta-karoten (15 mg). W preparacie AREDS-2 luteina (10 mg) i zeaksantyna (2 mg) zastąpiły beta-karoten ze względu na ryzyko raka płuc u palaczy przyjmujących beta-karoten. Te specyficzne suplementy mikroskładników odżywczych były związane z niższym ryzykiem progresji do cięższych postaci AMD i lepszą ostrością wzroku po 5 latach. Nie ma dowodów na to, że suplementacja mikroskładnikami odżywczymi zapobiega postępowi AMD u osób z ciężką chorobą lub zapobiega wystąpieniu choroby u osób bez AMD.
Suche AMD
Nie ma lekarstwa na suche AMD. Chociaż istnieje rosnące zainteresowanie akademickie i farmaceutyczne opracowaniem inhibitorów dopełniacza do leczenia zapalenia oka, w związku z kilkoma badaniami klinicznymi dotyczącymi suchej AMD, pierwszy taki środek, który zakończył badania fazy 3 w AMD (środek anty-czynnik D, lampalizumab) nie wpłynął istotnie poprawić tempo postępu choroby. Niemniej jednak trwają prace nad strategiami ukierunkowanymi na różne aspekty układu dopełniacza.
Mokre AMD
Ranibizumab , aflibercept , brolucizumab i faricimab są zatwierdzonymi inhibitorami VEGF do leczenia CNV w wysiękowej postaci AMD. Wszystkie trzy leki są podawane we wstrzyknięciu doszklistkowym , co oznacza, że są wstrzykiwane bezpośrednio do oka. Bewacyzumab jest kolejnym inhibitorem VEGF, który, jak wykazano, ma podobną skuteczność i bezpieczeństwo jak poprzednie dwa leki, jednak obecnie nie jest wskazany w leczeniu AMD. AMD można również leczyć laserową terapią koagulacyjną .
Randomizowane badanie kontrolne wykazało, że bewacyzumab i ranibizumab miały podobną skuteczność i nie odnotowano istotnego wzrostu zdarzeń niepożądanych po bewacyzumabie. Przegląd Cochrane z 2014 roku wykazał, że ogólnoustrojowe bezpieczeństwo bewacyzumabu i ranibizumabu jest podobne, gdy są stosowane w leczeniu wysiękowej postaci AMD, z wyjątkiem zaburzeń żołądkowo-jelitowych. Bewacizumab nie jest jednak zatwierdzony przez FDA do leczenia zwyrodnienia plamki żółtej. Kontrowersje w Wielkiej Brytanii dotyczyły off-label stosowanie tańszego bewacyzumabu w porównaniu z zatwierdzonym, ale drogim ranibizumabem. Ranibizumab jest mniejszym fragmentem, fragmentem Fab macierzystej cząsteczki bewacyzumabu, przeznaczonym specjalnie do wstrzyknięć do oka. Inne zatwierdzone leki antyangiogenne do leczenia wysiękowej postaci AMD obejmują pegaptanib i aflibercept .
Te środki anty-VEGF można podawać co miesiąc lub adaptacyjnie. W przypadku adaptacyjnego leczenia anty-VEGF konwencjonalnie stosuje się dwa podejścia. W przypadku prorenata pacjent przychodzi w ustalonych odstępach czasu, ale leczenie jest stosowane tylko w przypadku wykrycia aktywności (tj. obecności płynu). W przypadku leczenia i przedłużania pacjenci zawsze otrzymują leczenie, ale odstęp do kolejnej wizyty wydłuża się, jeśli zmiana była nieaktywna. Niedawno naukowcy zaczęli stosować algorytmy sztucznej inteligencji do przewidywania przyszłej potrzeby leczenia. Ale te podejścia nie zostały zatwierdzone do użytku klinicznego na dzień dzisiejszy.
Amerykańskiej Akademii Okulistycznej nie zalecają laserowej terapii koagulacyjnej w przypadku zwyrodnienia plamki żółtej, ale stwierdzają, że może ona być przydatna u osób z nowymi naczyniami krwionośnymi w naczyniówce poza dołkiem , które nie reagują na leczenie farmakologiczne. Istnieją mocne dowody na to, że koagulacja laserowa spowoduje zanik druz, ale nie wpływa na neowaskularyzację naczyniówkową . Przegląd Cochrane z 2007 roku wykazał, że laserowa fotokoagulacja nowych naczyń krwionośnych w naczyniówce poza dołkiem jest skuteczną i ekonomiczną metodą, ale korzyści są ograniczone w przypadku naczyń znajdujących się obok lub poniżej dołka.
Terapię fotodynamiczną stosowano również w leczeniu wysiękowej postaci AMD. Lek werteporfinę podaje się dożylnie; światło o określonej długości fali jest następnie przykładane do nieprawidłowych naczyń krwionośnych. To aktywuje werteporfinę niszczącą naczynia.
Operacja zaćmy może poprawić wyniki wzrokowe u osób z AMD, chociaż pojawiły się obawy, że operacja przyspieszy postęp AMD. Randomizowane kontrolowane badanie wykazało, że osoby, które przeszły natychmiastową operację usunięcia zaćmy (w ciągu dwóch tygodni) poprawiły ostrość wzroku i lepszą jakość życia niż osoby, które przeszły opóźnioną operację usunięcia zaćmy (6 miesięcy).
Zaproponowano radioterapię jako metodę leczenia wysiękowej postaci AMD, ale dowody przemawiające za zastosowaniem nowoczesnej radioterapii stereotaktycznej w połączeniu z anty-VEGF są obecnie niepewne i oczekuje się na wyniki trwających badań.
Nukleozydowe inhibitory odwrotnej transkrypcji, takie jak stosowane w terapii przeciw HIV, wiązały się ze zmniejszonym ryzykiem rozwoju zanikowego zwyrodnienia plamki żółtej. Dzieje się tak, ponieważ elementy Alu przechodzą w cytoplazmie odwrotną transkrypcję, w której pośredniczy L1 (białko), co skutkuje syntezą DNA. Pierwsze badania kliniczne są przygotowywane od stycznia 2021 r.
Urządzenia adaptacyjne
Ponieważ nie ma to wpływu na widzenie peryferyjne, osoby ze zwyrodnieniem plamki żółtej mogą nauczyć się wykorzystywać pozostałe widzenie do częściowej kompensacji. Pomoc i zasoby są dostępne w wielu krajach iw każdym stanie w USA. Organizowane są zajęcia dotyczące „niezależnego życia”, a niektóre technologie można uzyskać w stanowym wydziale rehabilitacji.
Urządzenia adaptacyjne mogą pomóc ludziom czytać. Należą do nich szkła powiększające, specjalne soczewki okularowe, komputerowe czytniki ekranu, okulary elektroniczne i systemy telewizyjne, które powiększają czytany materiał.
Czytniki ekranu komputera, takie jak JAWS lub Thunder, współpracują ze standardowymi komputerami z systemem Windows . Ponadto urządzenia Apple zapewniają szeroki zakres funkcji (nagrywanie głosu, czytniki ekranu, alfabet Braille'a itp.).
Kamery wideo można podłączyć do standardowych lub specjalnych monitorów komputerowych, a obraz można przybliżać i powiększać. Systemy te często zawierają ruchomy stół do przenoszenia materiałów pisanych.
Dostępne publikowanie zapewnia większe czcionki w drukowanych książkach, wzory ułatwiające śledzenie, audiobooki i książki DAISY z tekstem i dźwiękiem.
Epidemiologia

Częstość występowania zwyrodnienia plamki żółtej związanego z wiekiem jest wyższa u Europejczyków niż u Azjatów i Afrykanów. Nie ma różnicy w rozpowszechnieniu między Azjatami i Afrykanami. Częstość występowania zwyrodnienia plamki żółtej związanego z wiekiem i związanych z nim cech wzrasta wraz z wiekiem i jest niska u osób poniżej 55 roku życia. Palenie jest najsilniejszym modyfikowalnym czynnikiem ryzyka. Od 2008 roku zwyrodnienie plamki żółtej związane z wiekiem odpowiada za ponad 54% wszystkich przypadków utraty wzroku wśród białej populacji w Stanach Zjednoczonych. Szacuje się, że 8 milionów Amerykanów cierpi na wczesne zwyrodnienie plamki żółtej związane z wiekiem, z czego u ponad 1 miliona rozwinie się zaawansowane zwyrodnienie plamki żółtej związane z wiekiem w ciągu najbliższych 5 lat. W Wielkiej Brytanii zwyrodnienie plamki żółtej związane z wiekiem jest przyczyną ślepoty u prawie 42% osób, które straciły wzrok w wieku 65-74 lat, u prawie dwóch trzecich osób w wieku 75-84 lat i u prawie trzech czwartych osób w wieku 85 lat lat lub starszych.
Badania
Badania wskazują, że druzy związane z AMD mają podobny skład molekularny do płytek amyloidu beta (Aβ) i złogów w innych chorobach związanych z wiekiem, takich jak choroba Alzheimera i miażdżyca tętnic. Sugeruje to, że podobne szlaki mogą być zaangażowane w etiologię AMD i innych chorób związanych z wiekiem.
Badania genetyczne
Testy genetyczne mogą pomóc w ustaleniu, czy pacjent z AMD jest bardziej narażony na rozwój choroby i mogą informować o postępie choroby. Testy genetyczne mogą również pozwolić naukowcom określić, czy pacjenci z większym lub mniejszym prawdopodobieństwem zareagują na leczenie, takie jak leki anty-VEGF lub inhibitory dopełniacza. Istnieje jednak kilka wyzwań związanych z wykorzystaniem narzędzi predykcyjnych, które uwzględniają zmienność genetyczną w praktyce klinicznej. Oprócz naszego ograniczonego zrozumienia sposobu, w jaki różne warianty genetyczne i czynniki środowiskowe oddziałują na ryzyko AMD, polimorfizmy pojedynczych nukleotydów, które są powszechne w populacji, mają niewielki wpływ na poszczególnych pacjentów z AMD. Dlatego rośnie zainteresowanie zrozumieniem funkcjonalnych konsekwencji rzadkich mutacji, które często mają bardziej wyraźne skutki. Obecnie nie zaleca się wykonywania testów genetycznych jako wskazówek dotyczących postępowania klinicznego.
Przeszczep komórek macierzystych
Badane są terapie komórkowe z wykorzystaniem komórek macierzystych szpiku kostnego oraz przeszczep nabłonka barwnikowego siatkówki. Przeprowadzono wiele prób na ludziach z zachęcającymi wynikami.
Edycja genomu
Edycja genomu CRISPR-Cas9 może być stosowana w leczeniu wysiękowego zwyrodnienia plamki związanego z wiekiem spowodowanego przez VEGFA . Naukowcy opisali podejście, w którym zmodyfikowane lentiwirusy są wstrzykiwane do dotkniętych obszarów anatomicznych w celu przejściowej edycji, która może zmniejszyć obszar neowaskularyzacji naczyniówkowej o 63% bez wywoływania niepożądanych zmian poza celem lub odpowiedzi immunologicznej anty-Cas9.
RPE i L-DOPA w łagodzeniu wysiękowej postaci AMD
Nabłonek barwnikowy siatkówki (RPE) (patrz schemat) odgrywa istotną rolę w oku. Wydziela wiele różnych czynników, w tym co najmniej 22 białka ważne w utrzymaniu struktury, funkcji i mikrośrodowisk po obu stronach RPE. (Dwie strony RPE obejmują stronę naczyniówkową, gdzie tworzą się naczynia krwionośne i odżywiają oko, oraz stronę fotoreceptorową, z pręcikami i czopkami, które odbierają sygnały świetlne). W szczególności RPE wydziela czynnik wzrostu śródbłonka naczyniowego (VEGF ) na błonie podstawnej, z VEGF docierającym do naczyniówki włosowatej w celu utrzymania prawidłowego tworzenia naczyń krwionośnych w obszarze naczyniówki.
Wiele czynników, w tym czynniki genetyczne, niedotlenienie, stres oksydacyjny i stresory zapalne, może powodować patologiczną nadprodukcję VEGF przez RPE. Ta nadprodukcja powoduje nadmierne tworzenie się naczyń krwionośnych w obszarze naczyniówki (naczyniówki włosowate), co jest główną przyczyną wysiękowej postaci AMD.
Sztuczna inteligencja do przewidywania
Naukowcy badają, czy sztuczna inteligencja może pomóc w przewidywaniu wysiękowej postaci AMD na tyle wcześnie, aby umożliwić zapobieganie. W badaniu przetestowano model sztucznej inteligencji do przewidywania, czy osoby z wysiękową postacią AMD w jednym oku rozwiną ją w drugim oku w ciągu sześciu miesięcy. W porównaniu z lekarzami i optometrystami model AI dokładniej przewidywał rozwój.
Inne rodzaje
Istnieje kilka innych (rzadkich) rodzajów zwyrodnienia plamki żółtej o podobnych objawach, ale niezwiązanych etiologicznie z mokrym lub suchym zwyrodnieniem plamki żółtej związanym z wiekiem. Wszystkie są zaburzeniami genetycznymi, które mogą wystąpić w dzieciństwie lub w wieku średnim.
- Dystrofia plamki żółtaczkowatej
- Dystrofia dna oka Sorsby'ego jest autosomalną dominującą chorobą siatkówki charakteryzującą się nagłą utratą ostrości wzroku wynikającą z nieuleczalnej neowaskularyzacji podplamkowej
- Choroba Stargardta (młodzieńcze zwyrodnienie plamki żółtej, STGD) jest autosomalnym recesywnym zaburzeniem siatkówki charakteryzującym się młodzieńczą dystrofią plamki żółtej, zmianami obwodowej siatkówki i podsiatkówkowym odkładaniem się materiału podobnego do lipofuscyny.
Podobne objawy o bardzo różnej etiologii i różnym leczeniu mogą być spowodowane błoną nasiatkówkową lub fałdą plamki żółtej lub jakimkolwiek innym stanem wpływającym na plamkę, takim jak centralna retinopatia surowicza .
Godne uwagi przypadki
Zobacz też
- Okulistyka
- Plamka żółta siatkówki
- Niedowidzenie
- Terapia genowa ślepoty barw
- Terapia genowa ludzkiej siatkówki
- Terapia komórkami macierzystymi zwyrodnienia plamki żółtej