Insulina Aspart
 | |
| Dane kliniczne | |
|---|---|
| Nazwy handlowe | NovoLog, NovoRapid, Fiasp i inne |
| leki biopodobne | Kirsty, Trurapi, Truvelog |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a605013 |
| Dane licencyjne |
|
| Kategoria ciąży |
|
Drogi podawania |
Podskórnie , dożylnie |
| Kod ATC | |
| Status prawny | |
| Status prawny | |
| Identyfikatory | |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| Bank Leków | |
| ChemSpider |
|
| UNII | |
| KEGG | |
| CHEMBL | |
| Pulpit nawigacyjny CompTox ( EPA ) | |
| Dane chemiczne i fizyczne | |
| Formuła | C 256 H 381 N 65 O 79 S 6 |
| Masa cząsteczkowa | - 5825,60 g ·mol 1 |
|
| |
Insulina aspart , sprzedawana między innymi pod markami NovoLog i Fiasp , jest zmodyfikowanym rodzajem insuliny medycznej stosowanej w leczeniu cukrzycy typu 1 i typu 2 . Zwykle stosuje się go we wstrzyknięciu pod skórę , ale można go również podawać we wstrzyknięciu do żyły . Maksymalny efekt występuje po około 1-3 godzinach i utrzymuje się przez 3-5 godzin. potrzebna jest również insulina dłużej działająca, taka jak insulina NPH .
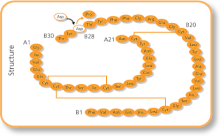
Częste działania niepożądane obejmują niski poziom cukru we krwi , reakcje alergiczne , swędzenie i ból w miejscu wstrzyknięcia. Inne poważne działania niepożądane mogą obejmować niski poziom potasu we krwi . Stosowanie w okresie ciąży i karmienia piersią jest ogólnie bezpieczne. Działa tak samo jak insulina ludzka , zwiększając ilość glukozy pobieranej przez tkanki i zmniejszając ilość glukozy wytwarzanej przez wątrobę. Jest to wyprodukowana forma insuliny ludzkiej; gdzie pojedynczy aminokwas został zmieniony, konkretnie prolina z kwasem asparaginowym w pozycji B28.
Insulina aspart została dopuszczona do użytku medycznego w Stanach Zjednoczonych w 2000 roku. W 2020 roku był to 80. najczęściej przepisywany lek w Stanach Zjednoczonych, z ponad 9 milionami recept. Do produkcji wykorzystuje się drożdże , którym w genomie umieszczono gen insuliny aspart . Drożdże te następnie wytwarzają insulinę, która jest zbierana z bioreaktora .
Zastosowania medyczne
Od 2018 roku brakuje przekonujących dowodów na wyższość insuliny aspart nad insuliną ludzką w cukrzycy typu 2 . Nie jest zatem jasne, dlaczego doszło do przejścia ludzi z insuliny ludzkiej na insulinę aspart. W cukrzycy typu 1 wydaje się, że skutkuje to nieco lepszą kontrolą poziomu cukru we krwi.
Początek akcji
Początek działania wynosi około piętnastu minut, szczyt działania osiągany jest po 45–90 minutach, a czas działania wynosi 3–5 godzin. Jednak, podobnie jak w przypadku wszystkich insulin, liczby te opierają się na wartościach średnich i różnią się u poszczególnych osób ze względu na przepływ krwi, miejsce wstrzyknięcia, temperaturę i wysiłek fizyczny.
Skutki uboczne
Bezpieczeństwo stosowania insuliny aspart u osób chorych na cukrzycę nie różni się od bezpieczeństwa stosowania insuliny zwykłej. Działania niepożądane często związane z terapią insuliną obejmują: reakcje alergiczne, podrażnienie w miejscu wstrzyknięcia, wysypki i hipoglikemię . Najczęstszym działaniem niepożądanym jest hipoglikemia. Długotrwałe stosowanie insuliny, w tym insuliny aspart, może powodować lipodystrofię w miejscu powtarzanych wstrzyknięć lub infuzji. Aby zmniejszyć ryzyko lipodystrofii, należy zmieniać miejsca wstrzyknięć w obrębie tego samego regionu. Podczas stosowania insuliny aspart może również wystąpić przyrost masy ciała, co przypisuje się anabolicznemu działaniu insuliny i zmniejszeniu cukromocz . Stosowanie insuliny aspart było również związane z zatrzymaniem sodu i obrzękami .
Właściwości chemiczne
Składnikami insuliny aspart są:
- Jon metalu – cynk (19,6 μg/mL)
- Bufor – dwuwodny wodorofosforan disodowy (1,25 mg/ml)
- Konserwanty – 3-metylofenol (m-krezol) (1,72 mg/mL) i fenol (1,50 mg/mL)
- Czynniki izotonizujące – gliceryna (16 mg/mL) i chlorek sodu (0,58 mg/mL).
pH insuliny aspart wynosi 7,2–7,6 .
preparaty
Insulina aspart może być stosowana w pompie insulinowej i wstrzykiwaczu insulinowym do wstrzyknięć podskórnych . Dodatkowo może być używany z portem iniekcyjnym, takim jak port I.
Insulina aspart ma szybszy początek i krótszy czas działania niż zwykła insulina ludzka. Dlatego insulina aspart podawana we wstrzyknięciach powinna być zwykle stosowana w schemacie z insuliną długo działającą lub insuliną o pośrednim czasie działania. Insulina aspart może być również stosowana z zewnętrznymi pompami insulinowymi . Insulina w zbiorniczkach pomp insulinowych i zestawach infuzyjnych powinna być wymieniana co 48 godzin, aby uniknąć degradacji insuliny i utraty środka konserwującego.
Temperatura
Dyskutowano, czy insulina aspart powinna być zawsze przechowywana w lodówce. Producent twierdzi, że może wytrzymać 28 dni bez chłodzenia, o ile jest utrzymywany w temperaturze poniżej 86 ° F / 30 ° C. Powyżej tych temperatur moc insuliny szybko spada, co czyni ją mniej skuteczną. [ potrzebne źródło ]
Wariacje
NovoLog Mix 70/30 to produkt zawierający 30% insuliny aspart i 70% protaminy insuliny aspart. Część protaminowa insuliny aspart jest krystaliczną postacią insuliny aspart, która opóźnia działanie insuliny, nadając jej przedłużony profil wchłaniania po wstrzyknięciu. Połączenie postaci szybko działającej i postaci długo działającej umożliwia pacjentowi otrzymywanie mniejszej liczby wstrzyknięć w ciągu dnia.
Składniki NovoLog Mix 70/30 są następujące: [ potrzebne źródło ]
- Jon metalu – cynk (19,6 μg/mL)
- Bufor – dwuzasadowy fosforan sodu (1,25 mg/ml)
- Konserwanty – m-krezol (1,72 mg/mL) i fenol (1,50 mg/mL)
- Czynniki izotoniczne – chlorek sodu (0,58 mg/mL) i mannitol (36,4 mg/mL)
- Białko modyfikujące – protamina (0,33 mg/ml)
pH wynosi 7,2–7,44.
NovoLog Mix jest sprzedawany do użytku z Novo Nordisk FlexPen. Początek działania jest krótszy niż 30 minut, szczyt działania osiągany jest w ciągu 1-4 godzin, a czas działania jest krótszy niż 24 godziny. NovoLog Mix jest sprzedawany w niektórych krajach jako NovoMix 30.
NovoRapid jest wytwarzany w Saccharomyces cerevisiae przy użyciu technologii rekombinacji DNA .
leki biopodobne
W dniu 10 grudnia 2020 roku Komitet ds. Produktów Leczniczych Stosowanych u Ludzi (CHMP) Europejskiej Agencji Leków (EMA) przyjął pozytywną opinię, rekomendując przyznanie pozwolenia na dopuszczenie do obrotu produktu leczniczego Kixelle, przeznaczonego do leczenia cukrzycy. Wnioskodawcą dla tego produktu leczniczego jest firma Mylan IRE Healthcare Limited. Kixelle został dopuszczony do użytku medycznego w Unii Europejskiej w lutym 2021 r. Kixelle został przemianowany na Kirsty.
Trurapi został dopuszczony do użytku medycznego w Kanadzie w październiku 2020 r.
Truvelog i Truvelog Solostar zostały zatwierdzone do użytku medycznego w Australii w październiku 2020 r.
W październiku 2021 roku Kirsty została dopuszczona do użytku medycznego w Kanadzie.
W dniu 24 lutego 2022 roku Komitet ds. Produktów Leczniczych Stosowanych u Ludzi (CHMP) Europejskiej Agencji Leków wydał pozytywną opinię, rekomendując przyznanie pozwolenia na dopuszczenie do obrotu produktu leczniczego Truvelog Mix 30, przeznaczonego do leczenia cukrzycy. Wnioskodawcą dla tego produktu leczniczego jest grupa Sanofi-Aventis. Został dopuszczony do użytku medycznego w Unii Europejskiej w kwietniu 2022 roku.
Linki zewnętrzne
- „Insulina aspart” . Portal informacyjny o lekach . Narodowa Biblioteka Medyczna Stanów Zjednoczonych.
