Muraglitazar
 | |
| Dane kliniczne | |
|---|---|
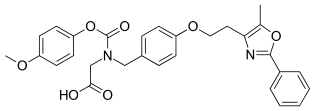
| Inne nazwy | kwas 2-[(4-metoksyfenoksy)karbonylo-[[4-[2-(5-metylo-2-fenylo-1,3-oksazol-4-ilo)etoksy]fenylo]metylo]amino]octowy |
| Kod ATC |
|
| Status prawny | |
| Status prawny |
|
| Identyfikatory | |
| |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CHEMBL | |
| Pulpit nawigacyjny CompTox ( EPA ) | |
| Dane chemiczne i fizyczne | |
| Formuła | C29H28N2O7 _ _ _ _ _ _ _ |
| Masa cząsteczkowa | 516,550 g·mol -1 |
| Model 3D ( JSmol ) | |
| |
| |
|
| |
Muraglitazar (proponowana nazwa handlowa Pargluva ) jest podwójnym agonistą receptora aktywowanego przez proliferatory peroksysomów z powinowactwem do PPARα i PPARγ .
Lek zakończył badania kliniczne III fazy , jednak w maju 2006 Bristol-Myers Squibb ogłosił, że zaprzestał dalszego rozwoju.
Dane dotyczące muraglitazaru są stosunkowo skąpe ze względu na niedawne wprowadzenie tego środka. W jednym randomizowanym badaniu klinicznym z podwójnie ślepą próbą porównującym muraglitazar i pioglitazon stwierdzono, że działanie tego pierwszego było korzystne pod względem zwiększenia HDL-C , zmniejszenia stężenia cholesterolu całkowitego , apolipoproteiny B , triglicerydów i większego zmniejszenia stężenia HbA1c 0,0001 ( p < dla wszystkich porównania). Jednak grupa muraglitazaru charakteryzowała się wyższą śmiertelnością z jakiejkolwiek przyczyny, większą częstością występowania i obrzęków niewydolność serca i większy przyrost masy ciała w porównaniu z grupą otrzymującą pioglitazon. Metaanaliza badań klinicznych fazy II i III muraglitazaru wykazała, że był on związany z większą częstością występowania zawału mięśnia sercowego , udaru , przemijających napadów niedokrwiennych i zastoinowej niewydolności serca (CHF) w porównaniu z placebo lub pioglitazonem.
Zwracając uwagę na zdarzenia niepożądane upublicznione w ramach procesu komitetu doradczego FDA, dr Nissen wpadł na mechanizm kierowania FDA z zewnątrz. Mechanizm ten zadziałał w przypadku rozyglitazonu (Avandia) i doprowadził do tego, że FDA zażądała wykazania bezpieczeństwa kardiologicznego dla nowych leków do leczenia cukrzycy typu 2. Proces ten został opisany przez dr Roberta Misbina w INSULIN-History from an FDA Insider, opublikowanym 1 czerwca 2020 r. na Amazon.