Zespół Cockayne'a
| Zespół Cockayne'a | |
|---|---|
| Inne nazwy | Zespół Neilla-Dingwalla |
 | |
| Specjalność |
Genetyka medyczna , neurologia , dermatologia |
Zespół Cockayne'a ( CS ), zwany także zespołem Neilla-Dingwalla , jest rzadką i śmiertelną autosomalną recesywną chorobą neurodegeneracyjną charakteryzującą się zaburzeniami wzrostu, zaburzeniami rozwoju układu nerwowego , nieprawidłową wrażliwością na światło słoneczne ( nadwrażliwością na światło ), zaburzeniami wzroku i przedwczesnym starzeniem się . Brak rozwoju i zaburzenia neurologiczne są kryteriami diagnozy, podczas gdy nadwrażliwość na światło, utrata słuchu, nieprawidłowości oczu i ubytki to inne bardzo częste cechy. Możliwe są problemy z jednym lub wszystkimi narządami wewnętrznymi. Jest to związane z grupą zaburzeń zwanych leukodystrofiami , które są stanami charakteryzującymi się degradacją neurologicznej istoty białej . Podstawowym zaburzeniem jest defekt w naprawy DNA . W przeciwieństwie do innych defektów naprawy DNA, pacjenci z CS nie są predysponowani do raka lub infekcji. Zespół Cockayne'a to rzadka, ale wyniszczająca choroba, która zazwyczaj kończy się śmiercią w pierwszej lub drugiej dekadzie życia. Mutacja określonych genów w zespole Cockayne'a jest znana, ale powszechne skutki i jej związek z naprawą DNA nie zostały jeszcze dobrze poznane.
Jej nazwa pochodzi od angielskiego lekarza Edwarda Alfreda Cockayne'a (1880–1956), który po raz pierwszy opisał ją w 1936 r. I ponownie opisał w 1946 r. Zespół Neilla-Dingwalla został nazwany na cześć Mary M. Dingwall i Catherine A. Neill. Ci dwaj naukowcy opisali przypadek dwóch braci z zespołem Cockayne'a i stwierdzili, że jest to ta sama choroba, którą opisał Cockayne. W swoim artykule obaj przyczynili się do pojawienia się objawów choroby poprzez odkrycie zwapnień w mózgu. Porównali również zespół Cockayne'a do tego, co jest obecnie znane jako zespół progerii Hutchinsona-Gilforda (HGPS), zwany wówczas progerią, ze względu na zaawansowane starzenie, które charakteryzuje oba zaburzenia.
typy
- CS typu I, „klasyczna” postać, charakteryzuje się prawidłowym wzrostem płodu z początkiem nieprawidłowości w pierwszych dwóch latach życia. Wzrok i słuch stopniowo się pogarszają. Ośrodkowy i obwodowy układ nerwowy stopniowo ulega degeneracji aż do śmierci w pierwszej lub drugiej dekadzie życia w wyniku poważnej degradacji neurologicznej. Atrofia korowa jest mniej dotkliwa w CS typu I.
- CS typu II jest obecny od urodzenia ( wrodzony ) i jest znacznie cięższy niż CS typu 1. Po urodzeniu wiąże się z bardzo niewielkim rozwojem neurologicznym. Śmierć zwykle następuje w wieku siedmiu lat. Ten specyficzny typ został również określony jako zespół mózgowo-oczno-twarzowo-szkieletowy (COFS) lub zespół Pena-Shokeira typu II. Zespół COFS został tak nazwany ze względu na wpływ, jaki wywiera na mózg, oczy, twarz i układ kostny, ponieważ choroba często powoduje atrofię mózgu, zaćmę, utratę tłuszczu na twarzy i osteoporozę. Zespół COFS można dalej podzielić na kilka stanów (COFS typu 1, 2, 3 (związany z xeroderma pigmentosum ) i 4). Zazwyczaj pacjenci z tą wczesną postacią zaburzenia wykazują cięższe uszkodzenie mózgu, w tym zmniejszoną mielinizację istoty białej i bardziej rozległe zwapnienia, w tym w korze mózgowej i zwojach podstawy mózgu.
- CS Typ III, charakteryzujący się późnym początkiem, jest zwykle łagodniejszy niż Typy I i II. Często pacjenci z typem III dożyją dorosłości.
- Zespół Xeroderma pigmentosum-Cockayne (XP-CS) występuje, gdy dana osoba ma również Xeroderma pigmentosum, inną chorobę naprawy DNA. Niektóre objawy każdej choroby są wyrażone. Na przykład obecne są piegi i nieprawidłowości pigmentacyjne charakterystyczne dla XP. Obserwuje się zaburzenia neurologiczne, spastyczność i niedorozwój narządów płciowych charakterystyczne dla CS. Jednak hipomielinizacja i rysy twarzy typowych pacjentów z CS nie są obecne.
Powoduje
Jeśli w organizmie występuje hiperoksja lub nadmiar tlenu , metabolizm komórkowy wytwarza kilka wysoce reaktywnych form tlenu zwanych wolnymi rodnikami . Może to spowodować uszkodzenie oksydacyjne składników komórkowych, w tym DNA . W normalnych komórkach nasz organizm naprawia uszkodzone sekcje. W przypadku tej choroby, z powodu subtelnych defektów w transkrypcji , dziecięca maszyneria genetyczna do syntezy potrzebnych organizmowi białek nie pracuje z normalną wydajnością. Oznacza to, że naukowcy uważali, że maszyneria genetyczna tych dzieci do syntezy białek potrzebnych organizmowi nie działa z normalną wydajnością. Z czasem, zgodnie z tą teorią, prowadzi to do rozwojowego i śmierci. Co minutę organizm pompuje przez krew od 10 do 20 litrów tlenu , przenosząc go do miliardów komórek w naszym ciele. W swojej normalnej molekularnej tlen jest nieszkodliwy. Jednak metabolizm komórkowy z udziałem tlenu może generować kilka wysoce reaktywnych wolnych rodników. Te wolne rodniki mogą powodować uszkodzenia oksydacyjne składników komórkowych, w tym DNA. W przeciętnej ludzkiej komórce każdego dnia dochodzi do kilku tysięcy uszkodzeń DNA. Wiele z tych zmian wynika z uszkodzeń oksydacyjnych . Każde uszkodzenie — uszkodzony fragment DNA — musi zostać wycięte, a DNA naprawione, aby zachować jego normalne funkcje. Nienaprawione DNA może utracić zdolność kodowania białek. Mogą również wystąpić mutacje. Mutacje te mogą aktywować onkogeny lub wyciszać geny supresorowe nowotworów. Według badań uszkodzenia oksydacyjne aktywnych genów nie są preferencyjnie naprawiane, aw najcięższych przypadkach naprawa jest spowolniona w całym genomie . Wynikająca z tego akumulacja uszkodzeń oksydacyjnych może upośledzać normalne funkcje DNA, a nawet może prowadzić do uruchomienia programu śmierci komórki (apoptozy). Dzieci z tą chorobą nie naprawiają aktywnych genów, w których dochodzi do uszkodzeń oksydacyjnych. Zwykle naprawa uszkodzeń oksydacyjnych jest szybsza w aktywnych genach (które stanowią mniej niż pięć procent genomu) niż w nieaktywnych regionach DNA. Wynikająca z tego akumulacja uszkodzeń oksydacyjnych może upośledzać normalne funkcje DNA, a nawet może prowadzić do uruchomienia programu śmierci komórki ( apoptozy ).
Genetyka
Zespół Cockayne'a jest klasyfikowany genetycznie w następujący sposób: [ potrzebne źródło ]
| Typ | OMIM | Gen |
|---|---|---|
| A | 216400 | ERCC8 (zwany także CSA) |
| B | 133540 | ERCC6 (zwany także CSB) |
| C | 216411 | żaden znany |
- Przyczyną zespołu Cockayne'a są mutacje w genie ERCC8 (znanym również jako CSA) lub genie ERCC6 (znanym również jako CSB). Mutacje w mutacji genu ERCC6 stanowią ~ 70% przypadków. Białka wytwarzane przez te geny biorą udział w naprawie uszkodzonego DNA poprzez mechanizm naprawy sprzężonej z transkrypcją , w szczególności DNA w aktywnych genach. Uszkodzenia DNA są powodowane przez promienie ultrafioletowe pochodzące ze światła słonecznego, promieniowania lub wolnych rodników w organizmie. Normalna komórka może naprawić uszkodzenia DNA, zanim się nagromadzą. Jeśli gen ERCC6 lub ERCC8 jest zmieniony (jak w zespole Cockayne'a), uszkodzenia DNA napotkane podczas transkrypcji nie są naprawiane, co powoduje zatrzymanie polimerazy RNA w tym miejscu, zakłócając ekspresję genów. W miarę kumulowania się nienaprawionych uszkodzeń DNA coraz bardziej aktywna ekspresja genów jest hamowana, co prowadzi do nieprawidłowego działania komórek lub śmierci komórek, co prawdopodobnie przyczynia się do objawów zespołu Cockayne'a, takich jak przedwczesne starzenie się i hipomielinizacja neuronów.
Mechanizm
W przeciwieństwie do komórek z normalną zdolnością do naprawy, komórki z niedoborem CSA i CSB nie są w stanie preferencyjnie naprawić dimerów cyklobutanu pirymidyny indukowanych przez działanie światła ultrafioletowego (UV) na nić matrycową aktywnie transkrybowanych genów . Ten niedobór odzwierciedla utratę zdolności do wykonywania procesu naprawy DNA znanego jako naprawa przez wycinanie nukleotydów sprzężonych z transkrypcją (TC-NER).
W uszkodzonej komórce białko CSA normalnie lokalizuje się w miejscach uszkodzenia DNA , zwłaszcza w wiązaniach poprzecznych między niciami, pęknięciach dwuniciowych i niektórych monoadduktach. Białko CSB jest również zwykle rekrutowane do uszkodzonych miejsc DNA, a jego rekrutacja jest najszybsza i najsilniejsza w następujący sposób: międzyniciowe wiązania krzyżowe> pęknięcia dwuniciowe> monoaddukty> uszkodzenia oksydacyjne. Białko CSB tworzy kompleks z innym białkiem naprawy DNA, SNM1A ( DCLRE1A ), egzonukleazą 5' – 3' , która lokalizuje się w wiązaniach poprzecznych między niciami w sposób zależny od transkrypcji. Nagromadzenie białka CSB w miejscach pęknięć dwuniciowych DNA zachodzi w sposób zależny od transkrypcji i ułatwia homologiczną rekombinacyjną naprawę pęknięć. Podczas G0 / G1 cyklu komórkowego uszkodzenie DNA może wywołać zależny od CSB rekombinacyjny proces naprawy, który wykorzystuje matrycę RNA (zamiast DNA ).
Cechy przedwczesnego starzenia CS są prawdopodobnie przynajmniej częściowo spowodowane brakami w naprawie DNA (patrz teoria starzenia się uszkodzenia DNA ).
Diagnoza
Osoby z tym zespołem mają mniejsze niż normalnie rozmiary głowy ( małogłowie ), są niskiego wzrostu ( karłowatość ), ich oczy wydają się zapadnięte i mają „stary” wygląd. Często mają długie kończyny z przykurczami stawowymi (niemożność rozluźnienia mięśnia w stawie), zgarbione plecy ( kifoza ) i mogą być bardzo chude ( wyniszczenie ) z powodu utraty podskórnej tkanki tłuszczowej. Ich mały podbródek, duże uszy i spiczasty, cienki nos często nadają im postarzały wygląd. Skóra osób z zespołem Cockayne'a jest również często dotknięta: przebarwienia, żylaki lub pajączki ( telangiektazje ) oraz poważna wrażliwość na światło słoneczne są powszechne, nawet u osób bez XP-CS. Często pacjenci z zespołem Cockayne'a doznają poważnych oparzeń lub pęcherzy przy bardzo niewielkiej ekspozycji na ciepło. Na oczy pacjentów można wpływać na różne sposoby, a nieprawidłowości oczu są częste w CS. zaćma i zmętnienie rogówki ( zmętnienie rogówki ). Może wystąpić utrata i uszkodzenie nerwów nerwu wzrokowego, powodujące zanik nerwu wzrokowego. Oczopląs lub mimowolny ruch gałek ocznych i źrenice, które nie rozszerzają się, wykazują utratę kontroli nad dobrowolnymi i mimowolnymi ruchami mięśni. Typowym objawem jest również pigmentacja siatkówki typu sól i pieprz. Diagnozę ustala się na podstawie specjalnego testu naprawy DNA, który mierzy regenerację RNA po ekspozycji na promieniowanie UV. Pomimo powiązania z genami zaangażowanymi w naprawę przez wycinanie nukleotydów (NER), w przeciwieństwie do xeroderma pigmentosum , CS nie wiąże się ze zwiększonym ryzykiem raka.
Badania laboratoryjne
U pacjentów z zespołem Cockayne'a komórki napromieniowane promieniowaniem UV wykazują zmniejszoną syntezę DNA i RNA. https://emedicine.medscape.com/article/1115866-workup#c5 Badania laboratoryjne są przydatne głównie w celu wyeliminowania innych zaburzeń. Na przykład radiografia szkieletu, badania endokrynologiczne i badania pęknięć chromosomów mogą pomóc w wykluczeniu zaburzeń uwzględnionych w diagnostyce różnicowej. [ potrzebne źródło ]
Badania obrazowe
Tomografia komputerowa mózgu u pacjentów z zespołem Cockayne'a może ujawnić zwapnienia i zanik kory mózgowej.
Inne testy
Możliwa jest ocena prenatalna. Hodowla komórek płynu owodniowego służy do wykazania, że komórki płodu mają niedobór syntezy RNA po napromieniowaniu UV. [ potrzebne źródło ]
Neurologia
Badania obrazowe ujawniają powszechny brak osłonek mielinowych neuronów w istocie białej mózgu i ogólny zanik kory mózgowej. Zwapnienia znaleziono również w skorupie , obszarze przodomózgowia , który reguluje ruchy i pomaga w niektórych formach uczenia się, wraz z korą mózgową. Dodatkowo, atrofia centralnego obszaru móżdżku obserwowana u pacjentów z zespołem Cockayne'a może również skutkować brakiem kontroli mięśni, szczególnie mimowolnym, i typową wadą postawy. [ potrzebne źródło ]
Leczenie
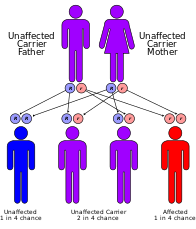
Nie ma trwałego lekarstwa na ten zespół, chociaż pacjentów można leczyć objawowo. Leczenie zwykle obejmuje fizjoterapię i drobne operacje na dotkniętych narządach, takie jak usunięcie zaćmy. Zaleca się również noszenie filtrów przeciwsłonecznych o wysokim współczynniku i odzieży ochronnej, ponieważ pacjenci z zespołem Cockayne'a są bardzo wrażliwi na promieniowanie UV. Pomocne może być również optymalne odżywianie. Zaleca się poradnictwo genetyczne dla rodziców, ponieważ zaburzenie ma 25% szans na przekazanie przyszłych dzieci, a także możliwe są badania prenatalne. Kolejnym ważnym aspektem jest zapobieganie nawrotom CS u innego rodzeństwa. Identyfikacja defektów genetycznych pozwala na objęcie poradami genetycznymi i diagnostyką prenatalną rodziców, którzy mają już jedno dotknięte chorobą dziecko.
Rokowanie
Rokowanie dla osób z zespołem Cockayne'a jest złe, ponieważ śmierć następuje zwykle w wieku 12 lat. Rokowanie dla zespołu Cockayne'a różni się w zależności od rodzaju choroby . Istnieją trzy typy zespołu Cockayne'a w zależności od nasilenia i początku objawów. Jednak różnice między typami nie zawsze są wyraźne, a niektórzy badacze uważają, że objawy przedmiotowe i podmiotowe odzwierciedlają spektrum zamiast odrębnych typów: Zespół Cockayne'a typu A (CSA) charakteryzuje się normalnym rozwojem do ukończenia przez dziecko 1 lub 2 lat stary, w którym to momencie wzrost spowalnia i zauważalne są opóźnienia rozwojowe. Objawy pojawiają się dopiero w wieku 1 roku. Oczekiwana długość życia dla typu A wynosi około 10 do 20 lat. Objawy te obserwuje się u dzieci z CS typu 1. Zespół Cockayne'a typu B (CSB), znany również jako „zespół mózgowo-oczno-twarzowo-szkieletowy (COFS)” (lub „zespół Pena-Shokeir typu B”), jest najpoważniejszym podtypem. Objawy są obecne przy urodzeniu, a normalny rozwój mózgu zatrzymuje się po urodzeniu. Średnia długość życia dzieci z typem B wynosi do 7 lat. Objawy te obserwuje się u dzieci z CS typu 2. Zespół Cockayne'a typu C (CSC) pojawia się później w dzieciństwie z łagodniejszymi objawami niż inne typy i wolniejszym postępem choroby. Osoby z tym typem zespołu Cockayne'a dożywają dorosłości, a średnia długość życia wynosi od 40 do 50 lat. Objawy te są widoczne w CS typu 3.
Epidemiologia
Zespół Cockayne'a jest rzadki na całym świecie. Nie zgłoszono żadnych predyspozycji rasowych do zespołu Cockayne'a. Nie opisano predylekcji seksualnych w przypadku zespołu Cockayne'a; stosunek liczby mężczyzn do kobiet jest równy. Zespół Cockayne'a I (CS-A) objawia się w dzieciństwie. Zespół Cockayne'a II (CS-B) objawia się przy urodzeniu lub w okresie niemowlęcym i ma gorsze rokowanie.
Najnowsze badania
Niedawne badania ze stycznia 2018 r. wymieniają różne cechy CS, które są postrzegane na całym świecie, z podobieństwami i różnicami: częstość występowania CS wynosi 1 na 250 000 żywych urodzeń, a częstość występowania wynosi około 1 na 2,5 miliona, co jest niezwykle spójne w różnych regionach na całym świecie:
| Dotknięte części | Cechy kliniczne | patologia |
|---|---|---|
| Twarz | Pomarszczone twarze. Zapadnięte oczy, duże uszy, cienki spiczasty nos. Mały podbródek. Próchnica zębów , hipoplazja szkliwa | |
| Skóra , włosy , paznokcie | światłoczułość . Pomarszczona i starzejąca się skóra. Cienkie, suche włosy, przedwcześnie siwe włosy. Słaby żylny . | |
| Ośrodkowy układ nerwowy | Małogłowie zwykle zaczyna się w wieku 2 lat. Upośledzenie umysłowe z niskim IQ . Opóźnione kamienie milowe . Wstrząsy , ataksja , drgawki , udary i krwotoki podtwardówkowe . |
Demielinizacja – jest niejednolita i segmentowa– „ leukodystrofia metachromatyczna ”. Dotknięte są zarówno komórki oligodendrogleju, jak i komórki Schwanna . Wpływa na istotę białą mózgu , ciało modzelowate , pień mózgu , rdzeń kręgowy i nerwy obwodowe . Utrata neuronów w wielu miejscach, zwłaszcza w móżdżku . Utrata komórek rogów przednich spowodowana postępującą i/lub wsteczną degeneracją . Zwapnienie [55–95%] kory mózgowej ( zwłaszcza głębi bruzdy , zwojów podstawy mózgu , móżdżku, wzgórza ; także tętnic , tętniczek i naczyń włosowatych ). naczyniowe - naczynia nitkowate, zwłaszcza w obszarach leukodystrofii metachromatycznej, zwapnień w naczyniach opon mózgowo-rdzeniowych , przyspieszonej miażdżycy i stwardnieniu tętnic . Glioza jest obecna. Astrocyty i mikroglej mogą wykazywać nieregularną cytoplazmę , liczne jądra . Może być postrzegana jako istota biała o dużym natężeniu w FLAIR MRI . Brak poważnych wad rozwojowych mózgu . Względne oszczędzanie kory mózgowej, widoczne lekkie przerzedzenie wstęgi korowej. Normalny wirowy z poszerzonymi bruzdami . Laminacja, rozmiar neuronów i konfiguracja kory nowej są zachowane. Może wykazywać potyliczną ciemieniową . Ciężki zanik móżdżku . Utrata Purkinjego , neuronów ziarnistych , aw niektórych przypadkach neuronów w jądrze zębatym . Dendryty komórek Purkinjego mogą być silnie zdeformowane („kwiaty kaktusa”), dendryty ferruginowane. Dendryty mają mniej gałęzi wyższego rzędu. Mogą być obecne „ torpedy aksonalne ” Purkinjego . Widoczne powiększenie komór , powiększona cisterna magna. Płytki amyloidowe , splątki neurofibrylarne , ciała Hirano rzadko spotykane, chociaż występuje reaktywność ubikwitynowa aksonów |
| słuchowe i przedsionkowe | Odbiorczy ubytek słuchu w zakresie wysokich tonów [60–90%]. Mieszany przewodzeniowy i czuciowo-nerwowy ubytek słuchu (44%) Najczęściej obustronny, rzadko jednostronny | Utrata komórek rzęsatych w ślimaku , szczególnie w zwoju podstawy . Utrata neuronów w zwoju spiralnym . Zanik dróg słuchowych . Scala communis , pogrubiona kurara strzemiączka , poszerzony prototympanum . Utrata komórek rzęsatych w pars superior. Utrata neuronów w zwoju przedsionkowym . Zapadnięcie się przewodu endolimfatycznego części dolnej |
| Wizja |
Zmętnienie rogówki . Zaćma [36–86%]. Zwykle obustronne, większość rozwija się do 4 roku życia. Retinopatia barwnikowa („sól i pieprz”) [43–89%]. Zwężenie źrenic , Bladość tarczy nerwu wzrokowego , Enophthalmos , Wąskie szpary powiekowe . |
Niejednolita utrata granulek pigmentu melaniny . Odkładanie lipofuscyny , duże komórki obciążone pigmentem w dystrybucji okołonaczyniowej . Atrofia i hiperplazja nabłonka barwnikowego siatkówki . Utrata komórek w zwojach i zewnętrznych warstwach komórek jądrowych. Dotyczy to zarówno zewnętrznych, jak i wewnętrznych segmentów fotoreceptorów . Zanik nerwu wzrokowego z częściową demielinizacją , utratą aksonów i glejozą |
| Układ mięśniowo-szkieletowy | Karłowatość kachektyczna . przykurcze . Kifoza , skolioza . Zgarbiona postawa. Zanik mięśni . | Miopatia odnerwienia , zanik nieużywania |
| Układu sercowo-naczyniowego | Przyspieszone nadciśnienie . Rozszerzenie korzenia aorty . Kardiomiopatia . | Zwiększone pogrubienie błony wewnętrznej przyśrodkowej. Miażdżyca , miażdżyca . |
| Układ pokarmowy | Ciężki refluks . Nieprawidłowa motoryka przewodu pokarmowego . Wiele z nich ma przezskórne rurki gastrostomijne . Hepatomegalia , splenomegalia , zwiększona aktywność enzymów wątrobowych . Zmieniony metabolizm leków | - |
| Układ nerkowy | Niewydolność nerek | Tętnice nerkowe wykazują zmiany w zaawansowanej miażdżycy i stwardnieniu tętnic. Nerki jednostronne lub hipoplastyczne . |
| Układ rozrodczy | - | - |
| Mężczyźni | Mikropenis , mniejszy rozmiar jądra | - |
| kobiety | jajników . Zgłoszono pomyślną ciążę . | - |
| Układy hormonalne | Normalne drugorzędne cechy płciowe . Normalny hormon wzrostu , hormon stymulujący tarczycę , poziom wapnia | Prawidłowa przysadka mózgowa i tarczyca |
| Systemy ekrynowe | Zmniejszona produkcja potu , łez , śliny | - |
Zobacz też
- Choroba przyspieszonego starzenia
- Biogerontologia
- Choroba zwyrodnieniowa
- Zaburzenie genetyczne
- Zespół CAMFAK — uważany za formę (lub podzbiór) zespołu Cockayne'a
Linki zewnętrzne
- Ten artykuł zawiera część tekstu należącego do domeny publicznej z The US National Library of Medicine