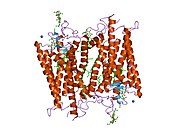
Rodopsyna
| RHO | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
| , CSNBAD1, OPN2, RP4, rodopsyna, Rodopsyna, fiolet wizualny | |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory zewnętrzne | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidane | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Rodopsyna , znana również jako fiolet wzrokowy , jest białkiem kodowanym przez gen RHO i receptor sprzężony z białkiem G (GPCR). Jest to opsyna znajdująca się w pręcikach siatkówki i światłoczułe białko receptorowe , które wyzwala wizualną fototransdukcję w pręcikach. Rodopsyna pośredniczy w widzeniu przy słabym świetle i dlatego jest niezwykle wrażliwa na światło. Pod wpływem światła rodopsyna natychmiast ulega fotowybielaniu . U ludzi następuje jego pełna regeneracja po około 30 minutach, po czym pręciki stają się bardziej wrażliwe. Defekty genu rodopsyny powodują choroby oczu, takie jak barwnikowe zwyrodnienie siatkówki i wrodzona stacjonarna ślepota nocna .
Nazwy
Rodopsyna została odkryta przez Franza Christiana Bolla w 1876 roku. Nazwa rodopsyna pochodzi od starogreckiego słowa ῥόδον ( rhódon ) oznaczającego „różę” ze względu na jej różowawy kolor oraz ὄψις ( ópsis ) oznaczającego „wzrok”. Zostało ukute w 1878 roku przez niemieckiego fizjologa Wilhelma Friedricha Kühne (1837-1900).
Kiedy George Wald odkrył, że rodopsyna jest holoproteiną składającą się z siatkówki i apoproteiny , nazwał ją opsyną, którą dziś można by opisać wężniej jako aporodopsynę. Obecnie termin opsyna odnosi się szerzej do klasy receptorów sprzężonych z białkiem G , które wiążą siatkówkę i w rezultacie stają się światłoczułym fotoreceptorem , obejmującym wszystkie blisko spokrewnione białka. Kiedy Wald i Colleges wyizolowali później jodopsynę z siatkówek kurczaków, odkrywając w ten sposób pierwszą znaną opsynę czopkową nazwali fotopsyną apo-jodopsyny (ze względu na jej związek z widzeniem fotopowym ) i skotopsyną apo-rodopsyny (ze względu na jej zastosowanie w widzeniu skotopowym ).
Ogólny
Rodopsyna to białko występujące w krążkach zewnętrznych segmentów pręcików . Pośredniczy w widzeniu skotopowym , czyli widzeniu monochromatycznym w słabym świetle. Rodopsyna najsilniej absorbuje światło zielono-niebieskie (~500 nm) i dlatego ma kolor czerwono-fioletowy, stąd archaiczne określenie „wizualny fiolet”.
Kilka blisko spokrewnionych opsyn różni się jedynie kilkoma aminokwasami i długościami fal światła, które najsilniej absorbują. Ludzie mają, w tym rodopsynę, dziewięć opsyn, a także kryptochrom (wrażliwy na światło, ale nie opsynę).
Struktura
Rodopsyna, podobnie jak inne opsyny, jest receptorem sprzężonym z białkiem G (GPCR). GPCR to chemoreceptory osadzone w dwuwarstwie lipidowej błon komórkowych i posiadające siedem domen transbłonowych tworzących kieszeń wiążącą dla liganda. Ligandem rodopsyny jest chromofor 11- cis - retinal na bazie witaminy A , który leży poziomo w stosunku do błony komórkowej i jest kowalencyjnie związany z lizyną reszta (lys296) w siódmej domenie transbłonowej poprzez zasadę Schiffa . Jednakże 11- cis -retinal blokuje jedynie kieszeń wiążącą i nie aktywuje rodopsyny. Jest aktywowany tylko wtedy, gdy 11- cis -retinal absorbuje foton światła i izomeryzuje do all- trans -retinalu, formy aktywującej receptor, powodując zmiany konforemne w rodopsynie (wybielanie), które aktywują kaskadę fototransdukcji . W ten sposób chemoreceptor przekształca się w foto(n)receptor światła .
Lizyna wiążąca się z siatkówką jest zachowana w prawie wszystkich opsynach, tylko w kilku opsynach utraciła ją podczas ewolucji . Opsyny bez lizyny, w tym rodopsyna, nie są wrażliwe na światło. Niektóre z tych mutacji powodują, że rodopsyna staje się konstytutywnie (w sposób ciągły) aktywna nawet bez światła. Również rodopsyna typu dzikiego jest konstytutywnie aktywna, jeśli nie jest związana 11- cis -retinal, ale znacznie mniej. Zatem 11- cis -retinal jest odwrotnym agonistą . Takie mutacje są jedną z przyczyn autosomalnego dominującego barwnikowego zapalenia siatkówki . Sztucznie, lizyna wiążąca siatkówkę może zostać przesunięta w inne pozycje, nawet do innych domen transbłonowych, bez zmiany aktywności.
Rodopsyna bydlęca ma 348 aminokwasów , a lizyną wiążącą siatkówkę jest Lys296. Była to pierwsza opsyna , której sekwencję aminokwasów i strukturę 3D określono. Jego strukturę szczegółowo zbadano metodą krystalografii rentgenowskiej na kryształach rodopsyny. Kilka modeli (np. mechanizm pedału roweru , mechanizm skrętu hula ) próbuje wyjaśnić, w jaki sposób grupa siatkówkowa może zmieniać swoją konformację bez zderzenia z otaczającą kieszenią białkową rodopsyny. Najnowsze dane potwierdzają, że rodopsyna jest funkcjonalnym monomerem, a nie dimerem, co przez wiele lat było paradygmatem receptorów sprzężonych z białkiem G.
Fototransdukcja

Rodopsyna jest niezbędnym receptorem sprzężonym z białkiem G w procesie fototransdukcji .
Aktywacja
W rodopsynie grupa aldehydowa siatkówki jest kowalencyjnie połączona z grupą aminową reszty lizyny na białku w protonowanej zasadzie Schiffa (-NH + = CH-). Kiedy rodopsyna absorbuje światło, jej kofaktor siatkówki ulega izomeryzacji z konfiguracji 11-cis do konfiguracji all-trans, a białko ulega następnie serii relaksacji, aby dostosować się do zmienionego kształtu izomeryzowanego kofaktora. Półprodukty powstałe w tym procesie zostały po raz pierwszy zbadane w laboratorium George'a Walda , który w 1967 r. otrzymał za te badania Nagrodę Nobla. Dynamikę fotoizomeryzacji badano następnie za pomocą czasowo-rozdzielczej spektroskopii IR i spektroskopii UV/Vis . Pierwszy fotoprodukt zwany fotorodopsyną tworzy się w ciągu 200 femtosekund po napromieniowaniu, a po nim w ciągu pikosekund powstaje drugi, zwany batorodopsyną , ze zniekształconymi wiązaniami all-trans. Ten półprodukt można uwięzić i badać w warunkach kriogenicznych temperatur i początkowo nazywano ją prelumirhodopsyną. W kolejnych związkach pośrednich , lumirhodopsynie i metarodopsynie I , wiązanie zasadowe Schiffa z siatkówką all-trans pozostaje protonowane, a białko zachowuje swój czerwonawy kolor. Krytyczna zmiana inicjująca pobudzenie neuronów polega na konwersji metarodopsyny I do metarodopsyny II , co jest związane z deprotonacją zasady Schiffa i zmianą koloru z czerwonego na żółty.
Kaskada fototransdukcji
Produkt aktywacji światłem, Metarhodopsyna II, inicjuje wizualny szlak fototransdukcji drugiego przekaźnika poprzez stymulację transdukcyny białka G (Gt ) , co powoduje uwolnienie jej podjednostki α. Ta podjednostka związana z GTP z kolei aktywuje fosfodiesterazę cGMP . Fosfodiesteraza cGMP hydrolizuje (rozkłada) cGMP , obniżając jego lokalne stężenie, przez co nie może już aktywować zależnych od cGMP kanałów kationowych . Prowadzi to do hiperpolaryzacji komórek fotoreceptorów, zmieniając szybkość, z jaką uwalniają one przekaźniki.
Dezaktywacja
Meta II (metarhodopsyna II) ulega szybkiej dezaktywacji po aktywacji transdukcyny przez kinazę rodopsyny i arestynę . Aby nastąpiła dalsza fototransdukcja, pigment rodopsyny musi zostać zregenerowany. Oznacza to zastąpienie all-trans-retinalu 11-cis-retinalem, a rozpad Meta II ma kluczowe znaczenie w tym procesie. Podczas rozpadu Meta II, wiązanie zasadowe Schiffa, które normalnie zawiera all-trans-siatkówkę i apoproteinę opsynę (aporodopsynę), ulega hydrolizie i staje się Meta III. W zewnętrznym segmencie pręcika Meta III rozpada się na oddzielne całkowicie trans-siatkówkowe i opsynę. Drugim produktem rozpadu Meta II jest całkowicie trans-siatkówkowy kompleks opsyny, w którym całkowicie trans-siatkówkowy kompleks został przeniesiony do drugiego miejsca wiązania. Wydaje się, że to, czy rozpad Meta II prowadzi do Meta III, czy do całkowicie trans-siatkówkowego kompleksu opsyny, zależy od pH reakcji. Wyższe pH ma tendencję do kierowania reakcji rozpadu w kierunku Meta III.
Choroby siatkówki
Mutacje w genie rodopsyny przyczyniają się głównie do różnych chorób siatkówki, takich jak barwnikowe zwyrodnienie siatkówki . Ogólnie rzecz biorąc, defekt rodopsyny łączy się z ubikwityną w ciałkach inkluzyjnych, zakłóca sieć włókien pośrednich i upośledza zdolność komórki do degradacji niefunkcjonujących białek, co prowadzi do apoptozy fotoreceptorów . Inne mutacje rodopsyny prowadzą do wrodzonej stacjonarnej ślepoty nocnej sprzężonej z chromosomem X , głównie z powodu konstytutywnej aktywacji, gdy mutacje zachodzą wokół kieszeni wiążącej chromofor rodopsyny. Odkryto kilka innych stanów patologicznych związanych z rodopsyną, w tym słaby ruch po zabiegu Golgiego, aktywację dysregulacyjną, niestabilność zewnętrznego segmentu pręcika i wiązanie arestyny.
Zobacz też
- Bakteriorodopsyna , stosowana u niektórych halobakterii jako pompa protonowa napędzana światłem .
Notatki wyjaśniające
Dalsza lektura
- Humphries P, Kenna P, Farrar GJ (maj 1992). „O genetyce molekularnej barwnikowego zwyrodnienia siatkówki”. Nauka . 256 (5058): 804–808. Bibcode : 1992Sci...256..804H . doi : 10.1126/science.1589761 . PMID 1589761 .
- Edwards SC (lipiec 1995). „Zaangażowanie cGMP i wapnia w fotoreakcję w komórkach fotoreceptorów kręgowców”. Journal of Florida Medical Association . 82 (7): 485–488. PMID 7673885 .
- al-Maghtheh M, Gregory C, Inglehearn C, Hardcastle A, Bhattacharya S (1993). „Mutacje rodopsyny w autosomalnym dominującym barwnikowym zwyrodnieniu siatkówki” . Mutacja człowieka . 2 (4): 249–255. doi : 10.1002/humu.1380020403 . PMID 8401533 . S2CID 28459589 .
- Garriga P, Manyosa J (wrzesień 2002). „Białko fotoreceptora oka, rodopsyna. Konsekwencje strukturalne dla chorób siatkówki” . Listy FEBS . 528 (1–3): 17–22. doi : 10.1016/S0014-5793(02)03241-6 . PMID 12297272 . S2CID 41860711 .
- Inglehearn CF, Keen TJ, Bashir R, Jay M, Fitzke F, Bird AC i in. (kwiecień 1992). „Wypełniony ekran mutacji genu rodopsyny w panelu pacjentów z autosomalnym dominującym barwnikowym zwyrodnieniem siatkówki”. Genetyka molekularna człowieka . 1 (1): 41–45. doi : 10.1093/hmg/1.1.41 . PMID 1301135 .
- Farrar GJ, Findlay JB, Kumar-Singh R, Kenna P, Humphries MM, Sharpe E, Humphries P (grudzień 1992). „Autosomalne dominujące barwnikowe zwyrodnienie siatkówki: nowa mutacja w genie rodopsyny w oryginalnej rodzinie połączonej z 3q”. Genetyka molekularna człowieka . 1 (9): 769–771. doi : 10.1093/hmg/1.9.769 . PMID 1302614 .
- Robinson PR, Cohen GB, Zhukovsky EA, Oprian DD (październik 1992). „Konstytutywnie aktywne mutanty rodopsyny”. Neuronie . 9 (4): 719–725. doi : 10.1016/0896-6273(92)90034-B . PMID 1356370 . S2CID 13172583 .
- Fujiki K, Hotta Y, Hayakawa M, Sakuma H, Shiono T, Noro M i in. (czerwiec 1992). „Mutacje punktowe genu rodopsyny występujące w japońskich rodzinach z autosomalnym dominującym barwnikowym zwyrodnieniem siatkówki (ADRP)” . Japoński dziennik genetyki człowieka . 37 (2): 125–132. doi : 10.1007/BF01899733 . PMID 1391967 .
- Olsson JE, Gordon JW, Pawlyk BS, Roof D, Hayes A, Molday RS i in. (listopad 1992). „Transgeniczne myszy z mutacją rodopsyny (Pro23His): mysi model autosomalnego dominującego barwnikowego zwyrodnienia siatkówki”. Neuronie . 9 (5): 815–830. doi : 10.1016/0896-6273(92)90236-7 . PMID 1418997 . S2CID 37524461 .
- Andréasson S, Ehinger B, Abrahamson M, Fex G (wrzesień 1992). „Rodzina sześciopokoleniowa z autosomalnym dominującym barwnikowym zwyrodnieniem siatkówki i mutacją genu rodopsyny (arginina-135-leucyna)”. Okulistyka, pediatria i genetyka . 13 (3): 145–153. doi : 10.3109/13816819209046483 . PMID 1484692 .
- Inglehearn CF, Lester DH, Bashir R, Atif U, Keen TJ, Sertedaki A i in. (marzec 1992). „Rekombinacja rodopsyny i locus D3S47 (C17) w rodzinach rodopsyny barwnikowego zwyrodnienia siatkówki” . American Journal of Human Genetics . 50 (3): 590–597. PMC 1684283 . PMID 1539595 .
- Fishman GA, Stone EM, Gilbert LD, Sheffield VC (maj 1992). „Odkrycia oczne związane z mutacją kodonu 106 genu rodopsyny. Zmiana glicyny na argininę w autosomalnym dominującym barwnikowym zwyrodnieniu siatkówki”. Archiwa Okulistyki . 110 (5): 646–653. doi : 10.1001/archopht.1992.01080170068026 . PMID 1580841 .
- Keen TJ, Inglehearn CF, Lester DH, Bashir R, Jay M, Bird AC i in. (wrzesień 1991). „Autosomalne dominujące barwnikowe zwyrodnienie siatkówki: cztery nowe mutacje w rodopsynie, jedna z nich w miejscu przyczepu siatkówki”. Genomika . 11 (1): 199–205. doi : 10.1016/0888-7543(91)90119-Y . PMID 1765377 .
- Dryja TP, Hahn LB, Cowley GS, McGee TL, Berson EL (październik 1991). „Widmo mutacji genu rodopsyny u pacjentów z autosomalnym dominującym barwnikowym zwyrodnieniem siatkówki” . Proceedings of National Academy of Sciences Stanów Zjednoczonych Ameryki . 88 (20): 9370–9374. Kod Biblijny : 1991PNAS...88.9370D . doi : 10.1073/pnas.88.20.9370 . PMC 52716 . PMID 1833777 .
- Gal A, Artlich A, Ludwig M, Niemeyer G, Olek K, Schwinger E, Schinzel A (październik 1991). „Mutacja Pro-347-Arg genu rodopsyny w autosomalnym dominującym barwnikowym zwyrodnieniu siatkówki”. Genomika . 11 (2): 468–470. doi : 10.1016/0888-7543(91)90159-C . PMID 1840561 .
- Sung CH, Davenport CM, Hennessey JC, Maumenee IH, Jacobson SG, Heckenlily JR i in. (sierpień 1991). „Mutacje rodopsyny w autosomalnym dominującym barwnikowym zwyrodnieniu siatkówki” . Proceedings of National Academy of Sciences Stanów Zjednoczonych Ameryki . 88 (15): 6481–6485. Kod Biblijny : 1991PNAS...88.6481S . doi : 10.1073/pnas.88.15.6481 . PMC 52109 . PMID 1862076 .
- Jacobson SG, Kemp CM, Sung CH, Nathans J (wrzesień 1991). „Funkcja siatkówki i poziomy rodopsyny w autosomalnym dominującym barwnikowym zapaleniu siatkówki z mutacjami rodopsyny” . Amerykański dziennik okulistyki . 112 (3): 256–271. doi : 10.1016/s0002-9394(14)76726-1 . PMID 1882937 .
- Sheffield VC, Fishman GA, Beck JS, Kimura AE, Stone EM (październik 1991). „Identyfikacja nowych mutacji rodopsyny związanych z barwnikowym zwyrodnieniem siatkówki za pomocą elektroforezy w żelu w gradiencie denaturującym z zaciskiem GC” . American Journal of Human Genetics . 49 (4): 699–706. PMC 1683182 . PMID 1897520 .
Linki zewnętrzne
- Rodopsyna w Narodowej Bibliotece Medycznej Stanów Zjednoczonych Nagłówki tematów medycznych (MeSH)
- Kolb H, Fernandez E, Nelson R, Jones BW (1 marca 2010). „Strona główna Webvision: Organizacja siatkówki i układu wzrokowego” . Uniwersytet Utah.
- Białko rodopsyny
- Fotoizomeryzacja rodopsyny , animacja.
- Rodopsyna i oko , podsumowanie ze zdjęciami.