Receptor sierocy alfa związany z RAR
| RORA | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
| , NR1F1, ROR1, ROR2, ROR3, RZR-ALPHA, RZRA, RAR związany z receptorem sierocym A, IDDECA | |||||||||||||||||||||||||||||||||||||||||||||||
| Zewnętrzne identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidane | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Powiązany z RAR sierocy receptor alfa ( RORα ), znany również jako NR1F1 (podrodzina receptorów jądrowych 1, grupa F, członek 1) jest receptorem jądrowym kodowanym u ludzi przez gen RORA . RORα uczestniczy w regulacji transkrypcji niektórych genów zaangażowanych w rytm dobowy . U myszy RORα jest niezbędny do rozwoju móżdżku poprzez bezpośrednią regulację genów ulegających ekspresji w komórkach Purkinjego. Odgrywa także zasadniczą rolę w rozwoju wrodzonych komórek limfoidalnych typu 2 (ILC2), a zmutowane zwierzęta mają niedobór ILC2. Ponadto, chociaż komórki ILC3 i Th17 od myszy z niedoborem RORα są obecne w normalnej liczbie, są wadliwe pod względem wytwarzania cytokin.
Odkrycie
Pierwsze trzy ludzkie izoformy RORα zostały początkowo sklonowane i scharakteryzowane jako receptory jądrowe w 1994 r. przez Giguère i współpracowników, kiedy po raz pierwszy zbadano ich strukturę i funkcję.
Na początku XXI wieku różne badania wykazały, że RORα wykazuje rytmiczne wzorce ekspresji w cyklu dobowym w wątrobie , nerkach , siatkówce i płucach . Co ciekawe, mniej więcej w tym czasie stwierdzono, że obfitość RORα w jądrze nadskrzyżowaniowym ssaków ma charakter okołodobowy . RORα jest niezbędny dla prawidłowego rytmu dobowego u myszy , co wskazuje na jego znaczenie w chronobiologii .
Struktura
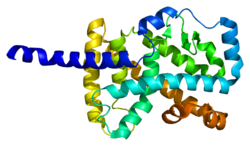
Białko kodowane przez ten gen należy do podrodziny NR1 jądrowych receptorów hormonalnych. U ludzi zidentyfikowano 4 izoformy RORα, które powstają w wyniku alternatywnego splicingu i użycia promotora i wykazują zróżnicowaną ekspresję specyficzną dla tkanki. Struktura białka RORα składa się z czterech kanonicznych grup funkcyjnych: domeny N-końcowej (A/B), domeny wiążącej DNA zawierającej dwa palce cynkowe , domeny zawiasowej i liganda C-końcowego -domena wiążąca. W rodzinie ROR domena wiążąca DNA jest wysoce konserwatywna, a domena wiążąca ligand jest konserwatywna jedynie umiarkowanie. Różne izoformy RORα mają różną specyficzność wiązania i siłę transkrypcyjnej .
Regulacja rytmu dobowego
Podstawowym zegarem dobowym ssaków jest pętla ujemnego sprzężenia zwrotnego , na którą składają się Per1/Per2 , Cry1/Cry2 , Bmal1 i Clock . Ta pętla sprzężenia zwrotnego jest stabilizowana przez inną pętlę obejmującą regulację transkrypcji Bmal1 . Transaktywacja Bmal1 jest regulowana przez element odpowiedzi ROR/REV-ERB (RRE) w promotorze Bmal1 , do którego należą RORα i REV-ERBα wiązać. Ta stabilizująca pętla regulacyjna sama w sobie jest indukowana przez heterodimer Bmal1/Clock , który indukuje transkrypcję RORα i REV-ERBα . RORα, który aktywuje transkrypcję Bmal1 i REV-ERBα, który hamuje transkrypcję Bmal1 , konkurują o wiązanie się z RRE. Uważa się , że ta pętla sprzężenia zwrotnego regulująca ekspresję Bmal1 stabilizuje mechanizm zegara rdzenia, pomagając go buforować przed zmianami w środowisku .
Mechanizm
Specyficzne powiązanie z elementami ROR (RORE) w regionach regulacyjnych jest niezbędne do funkcjonowania RORα jako aktywatora transkrypcji. RORα osiąga to poprzez specyficzne wiązanie z motywem rdzenia konsensusu w RORE, RGGTCA. Ta interakcja jest możliwa dzięki powiązaniu pierwszego palca cynkowego RORα z motywem rdzenia w głównym rowku, P-box i powiązaniu jego przedłużenia na C-końcu z regionem bogatym w AT w regionie 5' RORE.
Homologia
Wszystkie RORα, RORβ i RORγ są aktywatorami transkrypcji rozpoznającymi elementy odpowiedzi na ROR. ROR-alfa ulega ekspresji w różnych typach komórek i bierze udział w regulacji kilku aspektów rozwoju, reakcji zapalnych i rozwoju limfocytów . Izoformy RORα (RORα1 do RORα3) powstają w wyniku alternatywnej obróbki RNA, przy czym RORα2 i RORα3 mają wspólny region N-końcowy inny niż RORα1. W przeciwieństwie do RORα, RORβ ulega ekspresji w centralnego układu nerwowego (OUN) zaangażowanych w przetwarzanie informacji sensorycznych i generowanie rytmy dobowe , podczas gdy RORγ ma kluczowe znaczenie w organogenezie węzłów chłonnych i grasicy .
Domeny wiążące DNA sierocego receptora DHR3 u Drosophila wykazują szczególnie bliską homologię w obrębie regionów aminowych i karboksylowych sąsiadujących z regionem drugiego palca cynkowego w RORα, co sugeruje, że ta grupa reszt jest ważna dla funkcjonalności białek.
PDP1 i VRI u Drosophila regulują rytm dobowy, konkurując o to samo miejsce wiązania, pole VP, podobnie jak ROR i REV-ERB konkurencyjnie wiążą się z RRE. PDP1 i VRI tworzą pętlę sprzężenia zwrotnego i są funkcjonalnymi homologami ROR i REV-ERB u ssaków.
Bezpośrednie ortologie tego genu zidentyfikowano u myszy i ludzi.
ludzkiego cytochromu c HC2 i RORα mają wspólną organizację genomową pokrywającą się z pseudogenem HC2 zlokalizowanym w jednostce transkrypcyjnej RORα2. Sekwencje nukleotydowe i wywnioskowane sekwencje aminokwasowe pseudogenu przetwarzanego przez cytochrom c znajdują się na sensownej , podczas gdy sekwencje aminokońcowego eksonu RORα2 znajdują się na nici antysensownej.
Interakcje
- DNA: RORα wiąże się z P-boxem RORE.
-
Koaktywatory :
-
SRC-1 , CBP , p300 , TRIP-1, TRIP-230, białko pośredniczące w transkrypcji-1 ( TIF-1 ), białko wiążące proliferatory peroksysomów (PBP) i GRIP-1 fizycznie oddziałują z RORα.
- Motyw LXXLL: ROR oddziałuje z SRC-1, GRIP-1, CBP i p300 poprzez motywy LXXLL (L = leucyna, X = dowolny aminokwas) na tych białkach.
-
SRC-1 , CBP , p300 , TRIP-1, TRIP-230, białko pośredniczące w transkrypcji-1 ( TIF-1 ), białko wiążące proliferatory peroksysomów (PBP) i GRIP-1 fizycznie oddziałują z RORα.
- Ubikwitynacja : RORα jest celem proteasomu poprzez ubikwitynację. Ko -represor , Hairless, stabilizuje RORα, chroniąc go przed tym procesem, który również tłumi RORα.
- Sumoilacja : UBE21/UBC9: Enzym I koniugujący ubikwitynę oddziałuje z ROR, ale jego działanie nie jest jeszcze znane.
-
Fosforylacja :
- Fosforylacja RORα1, która hamuje jego aktywność transkrypcyjną, jest indukowana przez kinazę białkową C.
- ERK2 : Kinaza 2 regulowana sygnałem zewnątrzkomórkowym również fosforyluje RORα.
- ATXN1 : ATXN1 i RORα tworzą część kompleksu białkowego w komórkach Purkinjego .
- FOXP3 : FOXP3 bezpośrednio tłumi aktywność transkrypcyjną ROR.
- NME1 : Wykazano, że ROR specyficznie oddziałuje z NME1.
- NM23-2 : NM23-2 to kinaza difosforanu nukleozydu zaangażowana w organogenezę i różnicowanie.
- NM23-1 : NM23-1 jest produktem potencjalnego genu supresorowego przerzutów nowotworowych .
Jako cel narkotyków
Ponieważ RORα i REV-ERBα są receptorami jądrowymi, które mają te same geny docelowe i biorą udział w procesach regulujących metabolizm , rozwój , odporność i rytm dobowy, wykazują one potencjał jako cele leków . Syntetyczne ligandy mają wiele potencjalnych zastosowań terapeutycznych i można je stosować w leczeniu chorób takich jak cukrzyca , miażdżyca , choroby autoimmunologiczne i nowotwory . Stwierdzono, że dwa syntetyczne ligandy T0901317 i SR1001 są odwrotnością RORα i RORγ agoniści , którzy hamują aktywność reporterową i wykazano, że opóźniają wystąpienie i nasilenie kliniczne stwardnienia rozsianego i innych chorób autoimmunologicznych zależnych od komórek Th17 . Odkryto, że SR1078 jest agonistą RORα i RORγ, który zwiększa ekspresję G6PC i FGF21, dając potencjał terapeutyczny w leczeniu otyłości i cukrzycy, a także raka piersi , jajników i prostaty . Odkryto również, że SR3335 jest odwrotnym agonistą RORα.
Zobacz też
Dalsza lektura
- Giguère V, Beatty B, Squire J, Copeland NG, Jenkins NA (sierpień 1995). „Sierocy receptor jądrowy ROR alfa (RORA) odwzorowuje konserwatywny region homologii na ludzkim chromosomie 15q21-q22 i mysim chromosomie 9”. Genomika . 28 (3): 596–8. doi : 10.1006/geno.1995.1197 . PMID 7490103 .
- Steinhilber D, Brungs M, Werz O, Wiesenberg I, Danielsson C, Kahlen JP, Nayeri S, Schräder M, Carlberg C (marzec 1995). „Receptor jądrowy dla melatoniny tłumi ekspresję genu 5-lipoksygenazy w ludzkich limfocytach B” . Journal of Biological Chemistry . 270 (13): 7037–40. doi : 10.1074/jbc.270.13.7037 . PMID 7706239 .
- Forman BM, Chen J, Blumberg B, Kliewer SA, Henshaw R, Ong ES, Evans RM (wrzesień 1994). „Rozmowa między ROR alfa 1 i rodziną Rev-erb sierocych receptorów jądrowych” . Endokrynologia molekularna . 8 (9): 1253–61. doi : 10.1210/mend.8.9.7838158 . PMID 7838158 .
- Becker-André M, André E, DeLamarter JF (sierpień 1993). „Identyfikacja mRNA receptorów jądrowych przez amplifikację RT-PCR konserwatywnych sekwencji motywu palca cynkowego”. Komunikaty dotyczące badań biochemicznych i biofizycznych . 194 (3): 1371–9. doi : 10.1006/bbrc.1993.1976 . PMID 7916608 .
- Carlberg C, Hooft van Huijsduijnen R, Staple JK, DeLamarter JF, Becker-André M (czerwiec 1994). „RZR, nowa rodzina receptorów sierocych związanych z retinoidami, które działają zarówno jako monomery i homodimery” . Endokrynologia molekularna . 8 (6): 757–70. doi : 10.1210/mend.8.6.7935491 . PMID 7935491 . S2CID 22342101 .
- Paravicini G, Steinmayr M, André E, Becker-André M (październik 1996). „Kandydat na supresor przerzutów, kinaza nukleotydowo-difosforanowa NM23, specyficznie oddziałuje z członkami podrodziny jądrowych receptorów sierocych ROR / RZR”. Komunikaty dotyczące badań biochemicznych i biofizycznych . 227 (1): 82–7. doi : 10.1006/bbrc.1996.1471 . PMID 8858107 .
- Lau P, Bailey P, Dowhan DH, Muscat GE (styczeń 1999). „Egzogenna ekspresja dominującego negatywnego wektora RORalpha1 w komórkach mięśniowych upośledza różnicowanie: RORalpha1 bezpośrednio oddziałuje z p300 i myoD” . Badania kwasów nukleinowych . 27 (2): 411–20. doi : 10.1093/nar/27.2.411 . PMC 148194 . PMID 9862959 .
- Atkins GB, Hu X, Guenther MG, Rachez C, Freedman LP, Lazar MA (wrzesień 1999). „Koaktywatory sierocego receptora jądrowego RORalpha” . Endokrynologia molekularna . 13 (9): 1550–7. doi : 10.1210/mend.13.9.0343 . PMID 10478845 .
- Meyer T, Kneissel M, Mariani J, Fournier B (sierpień 2000). „Dowody in vitro i in vivo na funkcję sierocego receptora jądrowego RORalfa w metabolizmie kości” . Proceedings of National Academy of Sciences Stanów Zjednoczonych Ameryki . 97 (16): 9197–202. Kod Bib : 2000PNAS...97.9197M . doi : 10.1073/pnas.150246097 . PMC 16845 . PMID 10900268 .
- Gawlas K, Stunnenberg HG (grudzień 2000). „Różnicowe wiązanie i zachowanie transkrypcyjne dwóch wysoce spokrewnionych receptorów sierocych, ROR alfa (4) i ROR beta (1)”. Biochimica i Biophysica Acta . 1494 (3): 236–41. doi : 10.1016/s0167-4781(00)00237-2 . PMID 11121580 .
- Delerive P, Chin WW, Suen CS (wrzesień 2002). „Identyfikacja pogłosu (alfa) jako nowego genu docelowego ROR (alfa)” . Journal of Biological Chemistry . 277 (38): 35013–8. doi : 10.1074/jbc.M202979200 . PMID 12114512 .
- Moretti RM, Montagnani Marelli M, Motta M, Limonta P (2003). „Rola sierocego receptora jądrowego ROR alfa w kontroli zachowania przerzutowego niezależnych od androgenów komórek raka prostaty”. Raporty onkologiczne . 9 (5): 1139–43. doi : 10.3892/lub.9.5.1139 . PMID 12168086 .
- Raspè E, Mautino G, Duval C, Fontaine C, Duez H, Barbier O, Monte D, Fruchart J, Fruchart JC, Staels B (grudzień 2002). „Regulacja transkrypcji ekspresji ludzkiego genu Rev-erbalpha przez sierocy receptor jądrowy związany z kwasem retinowym sierocy receptor alfa” . Journal of Biological Chemistry . 277 (51): 49275–81. doi : 10.1074/jbc.M206215200 . PMID 12377782 .
- Kallen J, Schlaeppi JM, Bitsch F, Delhon I, Fournier B (kwiecień 2004). „Struktura krystaliczna domeny wiążącej ludzki ligand RORalfa w kompleksie z siarczanem cholesterolu przy 2,2 A” . Journal of Biological Chemistry . 279 (14): 14033–8. doi : 10.1074/jbc.M400302200 . PMID 14722075 .
- Migita H, Satozawa N, Lin JH, Morser J, Kawai K (styczeń 2004). „RORalpha1 i RORalpha4 hamują indukowaną TNF-alfa ekspresję VCAM-1 i ICAM-1 w ludzkich komórkach śródbłonka”. Listy FEBS . 557 (1–3): 269–74. doi : 10.1016/S0014-5793(03)01502-3 . PMID 14741380 . S2CID 24388280 .
- Miki N, Ikuta M, Matsui T (kwiecień 2004). „Wywołana niedotlenieniem aktywacja genu sierocego receptora alfa4 związanego z receptorem kwasu retinowego poprzez interakcję między indukowanym niedotlenieniem czynnikiem-1 i Sp1” . Journal of Biological Chemistry . 279 (15): 15025–31. doi : 10.1074/jbc.M313186200 . PMID 14742449 .
- Migita H, Morser J, Kawai K (marzec 2004). „Rev-erbalpha zwiększa ekspresję genów reagujących na NF-kappaB w komórkach mięśni gładkich naczyń” . Listy FEBS . 561 (1–3): 69–74. doi : 10.1016/S0014-5793(04)00118-8 . PMID 15013753 . S2CID 84456190 .
Linki zewnętrzne
- sierota+jądrowy+receptor+ROR-gamma w Amerykańskiej Narodowej Bibliotece Medycznej Medyczne nagłówki tematyczne (MeSH)