Chemia kwasu askorbinowego

|
|

|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
(5R ) -[(1S ) -1,2-dihydroksyetylo]-3,4-dihydroksyfuran-2(5H ) -on
|
|
| Inne nazwy Witamina C
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| Numer WE |
|
| Numer E | E300 (przeciwutleniacze, ...) |
| KEGG | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
|
|
|
| Nieruchomości | |
| C6H8O6 _ _ _ _ _ | |
| Masa cząsteczkowa | 176,124 g·mol -1 |
| Wygląd | Białe lub jasnożółte ciało stałe |
| Gęstość | 1,65 g/cm 3 |
| Temperatura topnienia | 190 do 192 ° C (374 do 378 ° F; 463 do 465 K) rozkłada się |
| 330 g/l | |
| Rozpuszczalność | Nierozpuszczalny w eterze dietylowym , chloroformie , benzenie , eterze naftowym , olejach , tłuszczach |
| Rozpuszczalność w etanolu | 20 g/l |
| Rozpuszczalność w glicerolu | 10 g/L |
| Rozpuszczalność w glikolu propylenowym | 50 g/l |
| Kwasowość ( p Ka ) | 4,10 (pierwszy), 11,6 (drugi) |
| Farmakologia | |
| A11GA01 ( KTO ) G01AD03 ( KTO ), S01XA15 ( KTO ) | |
| Zagrożenia | |
| NFPA 704 (ognisty diament) | |
| Śmiertelna dawka lub stężenie (LD, LC): | |
|
LD 50 ( mediana dawki )
|
11,9 g / kg (doustnie, szczur) |
| Karta charakterystyki (SDS) | JT Bakera |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Kwas askorbinowy jest związkiem organicznym o wzorze C
6 H
8 O
6 , pierwotnie nazywanym kwasem heksuronowym . Jest to białe ciało stałe, ale zanieczyszczone próbki mogą wydawać się żółtawe. Dobrze rozpuszcza się w wodzie dając lekko kwaśne roztwory. Jest łagodnym środkiem redukującym .
Kwas askorbinowy występuje w postaci dwóch enancjomerów ( izomerów w lustrzanym odbiciu ), powszechnie określanych jako „ l ” (od „levo”) i „ d ” (od „dextro”). Najczęściej spotykany jest izomer 1: występuje naturalnie w wielu produktach spożywczych i jest jedną z form („ witameru ” ) witaminy C , niezbędnego składnika odżywczego dla ludzi i wielu zwierząt. Niedobór witaminy C powoduje szkorbut , niegdyś główną chorobę żeglarzy podczas długich podróży morskich. Jest stosowany jako dodatek do żywności i suplement diety ze względu na swoje właściwości przeciwutleniające . Formę „ d ” można wytworzyć na drodze syntezy chemicznej , ale nie pełni ona istotnej roli biologicznej.
Historia
Antyszkorbutowe właściwości niektórych pokarmów zostały wykazane w XVIII wieku przez Jamesa Linda . W 1907 roku Axel Holst i Theodor Frølich odkryli, że czynnik przeciwszkorbutowy jest rozpuszczalną w wodzie substancją chemiczną, inną niż ta, która zapobiega beri-beri . W latach 1928-1932 Albert Szent-Györgyi wyizolował kandydata na tę substancję, którą nazwał „kwasem heksuronowym”, najpierw z roślin, a później z nadnerczy zwierząt. W 1932 roku Charles Glen King potwierdził, że rzeczywiście był to czynnik przeciwszkorbutowy.
W 1933 r. chemik cukrowy Walter Norman Haworth , pracując z próbkami „kwasu heksuronowego”, który Szent-Györgyi wyizolował z papryki i wysłał mu w poprzednim roku, wydedukował prawidłową strukturę i optyczno-izomeryczny charakter tego związku, a w 1934 r. jego pierwsza synteza. W odniesieniu do właściwości przeciwszkorbutowych związku, Haworth i Szent-Györgyi zaproponowali zmianę jego nazwy na „kwas a-skorbinowy” dla związku, a później konkretnie na kwas l -askorbinowy. Za ich pracę w 1937 roku Nagrody Nobla w dziedzinie chemii i medycyny otrzymali odpowiednio Haworth i Szent-Györgyi.
Właściwości chemiczne
Kwasowość
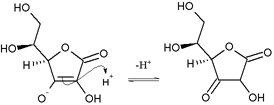
Kwas askorbinowy jest laktonem na bazie furanu i tworzy anion askorbinianowy po deprotonowaniu na jednej z grup hydroksylowych. Ta właściwość jest charakterystyczna dla reduktonów : enedioli z grupą karbonylową sąsiadującą z grupą enediolową, a mianowicie z grupą −C(OH)=C(OH)−C(=O)−. Anion askorbinianowy jest stabilizowany przez delokalizację elektronów, która wynika z rezonansu między dwiema formami:
Z tego powodu kwas askorbinowy jest znacznie bardziej kwaśny, niż można by się spodziewać, gdyby związek zawierał tylko izolowane grupy hydroksylowe.
Sole
Anion askorbinianowy tworzy sole , takie jak askorbinian sodu , askorbinian wapnia i askorbinian potasu .
estry
Kwas askorbinowy może również reagować z kwasami organicznymi jako alkohol , tworząc estry , takie jak palmitynian askorbylu i stearynian askorbylu .
Atak nukleofilowy
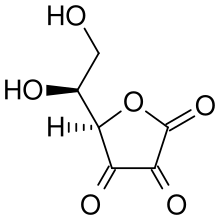
Atak nukleofilowy kwasu askorbinowego na proton skutkuje powstaniem 1,3-diketonu:
Utlenianie
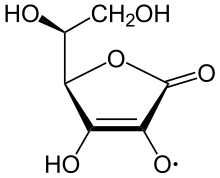
Jon askorbinianowy jest dominującym związkiem przy typowych biologicznych wartościach pH. Jest łagodnym środkiem redukującym i przeciwutleniaczem . Utlenia się z utratą jednego elektronu, tworząc rodnikowy kation , a następnie z utratą drugiego elektronu, tworząc kwas dehydroaskorbinowy . Zwykle reaguje z utleniaczami reaktywnych form tlenu , takimi jak rodnik hydroksylowy .
Kwas askorbinowy jest wyjątkowy, ponieważ może przenosić pojedynczy elektron dzięki stabilizowanemu rezonansowi charakterowi własnego jonu rodnikowego , zwanego semidehydroaskorbinianem . Reakcja netto to:
- RO • + do
6 H
7 O
− 6 → RO − + do 6 H 7 O
• 6 → ROH + do 6 H 6 O 6
Pod wpływem tlenu kwas askorbinowy ulegnie dalszemu rozkładowi oksydacyjnemu do różnych produktów, w tym kwasu diketogulonowego, kwasu ksylonowego , kwasu treonowego i kwasu szczawiowego .
Reaktywne formy tlenu są szkodliwe dla zwierząt i roślin na poziomie molekularnym ze względu na ich możliwe interakcje z kwasami nukleinowymi , białkami i lipidami. Czasami rodniki te inicjują reakcje łańcuchowe. Askorbinian może zakończyć te łańcuchowe reakcje rodnikowe poprzez przeniesienie elektronów . Utlenione formy askorbinianu są stosunkowo niereaktywne i nie powodują uszkodzeń komórek.
Jednak będąc dobrym donorem elektronów, nadmiar askorbinianu w obecności wolnych jonów metali może nie tylko promować, ale także inicjować reakcje wolnorodnikowe, co czyni go potencjalnie niebezpiecznym związkiem prooksydacyjnym w pewnych kontekstach metabolicznych.
Kwas askorbinowy i jego sole sodowe, potasowe i wapniowe są powszechnie stosowane jako przeciwutleniające dodatki do żywności . Związki te są rozpuszczalne w wodzie, a zatem nie mogą chronić tłuszczów przed utlenianiem: W tym celu rozpuszczalne w tłuszczach estry kwasu askorbinowego z długołańcuchowymi kwasami tłuszczowymi (palmitynian askorbylu lub stearynian askorbylu) mogą być stosowane jako przeciwutleniacze w żywności.
Inne reakcje
glukozą i aminokwasami w temperaturze 90°C tworzy lotne związki .
Jest kofaktorem w utlenianiu tyrozyny .
Używa
Dodatek do żywności
Głównym zastosowaniem kwasu l -askorbinowego i jego soli jest dodatek do żywności, głównie w celu zwalczania utleniania. Jest zatwierdzony do tego celu w UE z numerem E E300, USA, Australii i Nowej Zelandii.
Suplement diety
Innym ważnym zastosowaniem kwasu l -askorbinowego jest suplement diety .
Zastosowania niszowe, niespożywcze
- Kwas askorbinowy łatwo się utlenia i dlatego jest stosowany jako reduktor w roztworach do wywoływaczy fotograficznych (między innymi) oraz jako środek konserwujący .
- W mikroskopii fluorescencyjnej i pokrewnych technikach opartych na fluorescencji kwas askorbinowy może być stosowany jako przeciwutleniacz w celu zwiększenia sygnału fluorescencyjnego i chemicznego opóźnienia fotowybielania barwnika .
- Jest również powszechnie stosowany do usuwania plam z rozpuszczonych metali, takich jak żelazo, z powierzchni basenów z włókna szklanego.
- W produkcji tworzyw sztucznych kwas askorbinowy może być używany do szybszego składania łańcuchów molekularnych i przy mniejszej ilości odpadów niż tradycyjne metody syntezy.
- Wiadomo, że użytkownicy heroiny używają kwasu askorbinowego jako środka do przekształcania zasady heroiny w rozpuszczalną w wodzie sól, aby można ją było wstrzykiwać.
- Jak uzasadnia jego reakcja z jodem, służy do niwelowania wpływu jodu w tabletkach na oczyszczanie wody. Reaguje ze sterylizowaną wodą, usuwając smak, kolor i zapach jodu. Z tego powodu jest często sprzedawany jako drugi zestaw tabletek w większości sklepów z artykułami sportowymi jako tabletki neutralizujące wodę pitną wraz z tabletkami jodku potasu.
- Dożylny askorbinian w dużych dawkach jest stosowany jako środek modyfikujący odpowiedź chemioterapeutyczną i biologiczną . Obecnie jest jeszcze w fazie badań klinicznych.
- Czasami jest używany jako środek zakwaszający mocz w celu wzmocnienia antyseptycznego działania metenaminy .
Synteza
Naturalna biosynteza witaminy C zachodzi w wielu roślinach i zwierzętach w różnych procesach.
Preparat przemysłowy
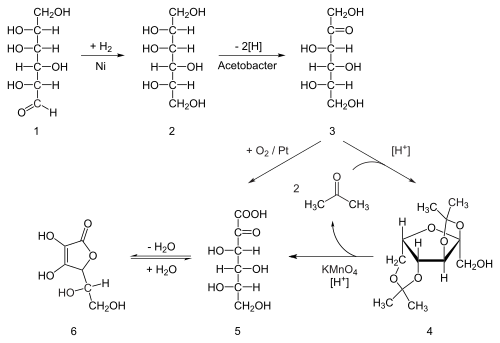
Osiemdziesiąt procent światowej podaży kwasu askorbinowego jest produkowane w Chinach. Kwas askorbinowy jest otrzymywany w przemyśle z glukozy metodą opartą na historycznym procesie Reichsteina . W pierwszym z pięcioetapowego procesu glukoza jest katalitycznie uwodorniana do sorbitolu , który jest następnie utleniany przez mikroorganizm Acetobacter suboxydans do sorbozy . Tylko jedna z sześciu grup hydroksylowych jest utleniana w tej reakcji enzymatycznej. Od tego momentu dostępne są dwie trasy. Traktowanie produktu acetonem w obecności kwaśnego katalizatora przekształca cztery z pozostałych grup hydroksylowych w acetale . Niezabezpieczona grupa hydroksylowa jest utleniana do kwasu karboksylowego w reakcji z utleniaczem katalitycznym TEMPO (regenerowanym podchlorynem sodu – roztworem wybielającym ). Historycznie rzecz biorąc, w przygotowaniu przemysłowym w procesie Reichsteina jako roztwór wybielający stosowano nadmanganian potasu . Katalizowana kwasem hydroliza tego produktu spełnia podwójną funkcję usuwania dwóch grup acetalowych i laktonizacji z zamknięciem pierścienia . Ten krok daje kwas askorbinowy. Każdy z pięciu etapów ma wydajność większą niż 90%.
Bardziej biotechnologiczny proces, opracowany po raz pierwszy w Chinach w latach 60. XX wieku, ale dalej rozwijany w latach 90., pomija stosowanie grup zabezpieczających aceton. Drugi genetycznie zmodyfikowany gatunek drobnoustroju, taki jak między innymi mutant Erwinia , utlenia sorbozę do kwasu 2-ketoglukonowego (2-KGA), który może następnie przejść laktonizację z zamknięciem pierścienia poprzez odwodnienie. Metoda ta jest stosowana w dominującym procesie stosowanym przez przemysł kwasu askorbinowego w Chinach, który dostarcza 80% światowego kwasu askorbinowego. Naukowcy amerykańscy i chińscy rywalizują o opracowanie mutanta, który może przeprowadzić fermentację w jednym naczyniu bezpośrednio z glukozy do 2-KGA, omijając zarówno potrzebę drugiej fermentacji, jak i potrzebę redukcji glukozy do sorbitolu.
Istnieje kwas d -askorbinowy, który nie występuje w przyrodzie, ale można go sztucznie zsyntetyzować. Mówiąc konkretnie, l -askorbinian bierze udział w wielu specyficznych reakcjach enzymatycznych, które wymagają prawidłowego enancjomeru ( l -askorbinian, a nie d -askorbinian). l -Kwas askorbinowy ma skręcalność właściwą [α]
20 D = +23°.
Determinacja
Tradycyjnym sposobem analizy zawartości kwasu askorbinowego jest proces miareczkowania środkiem utleniającym i opracowano kilka procedur.
Popularna metoda jodometryczna wykorzystuje jod w obecności wskaźnika skrobiowego . Jod jest redukowany przez kwas askorbinowy, a kiedy cały kwas askorbinowy przereagował, jod jest wtedy w nadmiarze, tworząc niebiesko-czarny kompleks ze wskaźnikiem skrobi. Oznacza to punkt końcowy miareczkowania.
Alternatywnie, kwas askorbinowy można potraktować nadmiarem jodu, a następnie przeprowadzić wsteczne miareczkowanie tiosiarczanem sodu z użyciem skrobi jako wskaźnika.
Ta metoda jodometryczna została zmieniona w celu wykorzystania reakcji kwasu askorbinowego z jodanem i jodkiem w roztworze kwasu . Elektroliza roztworu jodku potasu daje jod, który reaguje z kwasem askorbinowym. Zakończenie procesu określa się za pomocą miareczkowania potencjometrycznego w sposób podobny do miareczkowania Karla Fischera . Ilość kwasu askorbinowego można obliczyć z prawa Faradaya .
Inna alternatywa wykorzystuje N -bromosukcynoimid (NBS) jako środek utleniający, w obecności jodku potasu i skrobi. NBS najpierw utlenia kwas askorbinowy; kiedy ten ostatni jest wyczerpany, NBS uwalnia jod z jodku potasu, który następnie tworzy niebiesko-czarny kompleks ze skrobią.
Zobacz też
- Środek utrzymujący kolor
- Kwas erytorbinowy : diastereoizomer kwasu askorbinowego.
- Askorbiniany mineralne : sole kwasu askorbinowego
- Kwasy w winie
Uwagi i odniesienia
Dalsza lektura
- Clayden J, Greeves N, Warren S, Wothers P (2001). Chemia organiczna . Oxford University Press. ISBN 0-19-850346-6 .
- Davies MB, Austin J, Partridge DA (1991). Witamina C: jej chemia i biochemia . Królewskie Towarzystwo Chemii. ISBN 0-85186-333-7 .
- Koultat TP (1996). Jedzenie: chemia jego składników (wyd. 3). Królewskie Towarzystwo Chemii. ISBN 0-85404-513-9 .
- Gruenwald J, Brendler T, Jaenicke C, wyd. (2004). PDR dla leków ziołowych (wyd. 3). Montvale, New Jersey: Thomson PDR. ISBN 9781563635120 .
- McMurry J. (2008). Chemia organiczna (wyd. 7e). Nauka Thomsona. ISBN 978-0-495-11628-8 .
Linki zewnętrzne
- Międzynarodowa Karta Bezpieczeństwa Chemicznego 0379
- Raport z wstępnej oceny SIDS dotyczący kwasu L -askorbinowego sporządzony przez Organizację Współpracy Gospodarczej i Rozwoju (OECD)
- IPCS Monografia informacji o truciznach (PIM) 046
- Interaktywna struktura 3D witaminy C ze szczegółami dotyczącymi struktury rentgenowskiej