Benzanulacja Danheisera
Benzanulacja Danheisera to reakcja chemiczna stosowana w chemii organicznej do generowania wysoce podstawionych fenoli w jednym etapie. Jej nazwa pochodzi od Ricka L. Danheisera, który opracował reakcję.
Anulowanie
Anulację definiuje się jako przekształcenie jednego lub większej liczby acyklicznych prekursorów, w wyniku którego powstaje fuzja nowego pierścienia poprzez dwa nowo utworzone wiązania . Strategie te można wykorzystać do tworzenia układów aromatycznych z acyklicznych prekursorów w jednym kroku, z wieloma podstawnikami już na miejscu. Częstą syntetyczną reakcją annulacji jest annulacja Robinsona . Jest to przydatna reakcja do tworzenia pierścieni sześcioczłonowych i generowania związków policyklicznych. Jest to połączenie addycji Michaela i reakcji kondensacji aldolowej .
Rozwój reakcji
Wielopodstawione benzeny były pierwotnie syntetyzowane w reakcjach podstawienia prekursorów aromatycznych. Jednak reakcje te mogą mieć niską regioselektywność i są podatne na nadmierną substytucję. Ukierunkowana ortometalacja wymaga prekursorów, które często są niestabilne w stosunku do odczynników metalujących. Obie te drogi syntezy stwarzają problemy w całkowitej syntezie. W 1984 roku Rick Danheiser opracował nową strategię syntetyczną, aby zaradzić tym niedociągnięciom.
Reakcja
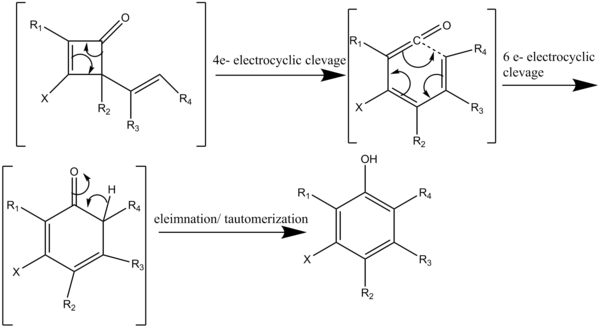
Benzannulacja Danheisera jest regiokontrolowaną anulacją fenolu . Ta anulacja zapewnia wydajną drogę do utworzenia pierścienia aromatycznego w jednym etapie. Jest to termiczne połączenie podstawionych cyklobutenonów z heteropodstawionymi acetylenami w celu wytworzenia silnie podstawionych związków aromatycznych, w szczególności fenoli lub rezorcynoli (Schemat 1). Ta reakcja benzannulacji tworzy wcześniej niedostępne wzorce podstawień aromatycznych. Za pomocą tej metody można otrzymać wiele podstawionych pierścieni aromatycznych, w tym: fenole, naftaleny , benzofurany , benzotiofeny , indole i karbazole .
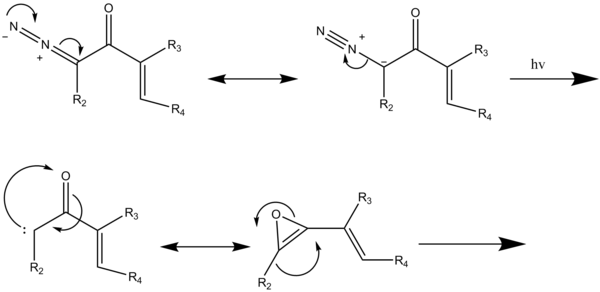
Zmodyfikowana benzannulacja Danheisera umożliwia syntezę wielopierścieniowych układów aromatycznych i heteroaromatycznych. Obejmuje to również naftaleny, benzofurany i indole. To pierścienie aromatyczne drugiej generacji uzyskuje się przez napromieniowanie roztworu acetylenu i α-diazoketonu winylowego lub arylowego w dichloroetanie . Ta reakcja wykorzystuje fotochemiczne przegrupowanie Wolffa diazoketonu w celu wytworzenia arylu lub winyloketenu. Tych półproduktów ketenowych nie można wyizolować ze względu na ich wysoką reaktywność w tworzeniu diketenów. Te przegrupowania przeprowadza się w obecności związków nienasyconych, które ulegają [2+2] cykloaddycjom z in situ . Kiedy keteny powstają w obecności alkinów, przechodzą przez reakcje pericykliczne , w wyniku których powstaje podstawiony pierścień aromatyczny (Schemat 2). Unikanie stosowania wysokoenergetycznych materiałów wyjściowych cyklobutenonu zapewnia dostęp do szerszej gamy podstawionych związków aromatycznych.
Ta reakcja jest dość komplementarna do reakcji Wulffa-Dötza . Jest to [2+1] cykloaddycja karbenu do alkinu lub alkenu (dokładniej w reakcji Dӧtza karben skoordynowany z metalową grupą karbonylową) w celu wytworzenia podstawionych fenoli aromatycznych .
Mechanizm
Reakcja przebiega kaskadą czterech kolejnych reakcji pericyklicznych (schemat 3). Ogrzanie cyklobutenonu powyżej 80 ° C inicjuje elektrocykliczne rozszczepienie czteroelektronowe, w wyniku którego powstaje winyloketen, który reaguje z acetylenem w regiospecyficznej [2+2] cykloaddycji (schemat 4). Odwracalne elektrocykliczne rozszczepienie 2-winylocyklobutenonu daje dienyloketen. Dienyloketen następnie przechodzi sześcioelektronową elektrocyklizację, dając heksadienonowy związek pośredni, który szybko tautomeryzuje, dając wysoce podstawione struktury fenolowe lub naftolowe.
W przypadku zmodyfikowanej reakcji benzannulacji (Schemat 5); napromieniowanie diazoketonów indukuje przegrupowanie Wolffa, w wyniku którego powstaje keten winylowy, związek pośredni, który reaguje z acetylenem w cykloaddycji [2 + 2], a następnie czteroelektronowe rozszczepienie powstałego 4-podstawionego cyklobuteonu daje dienyloketen, który następnie przechodzi sześcioelektronową elektrocyklizację dając 2,4-cykloheksanodion, który tautomeryzuje do końcowego produktu aromatycznego.
Warunki reakcji
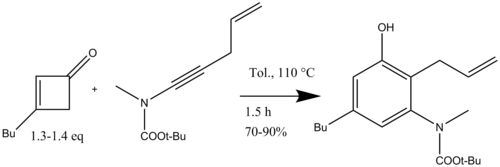
Typową reakcję benzannulacji firmy Danheiser prowadzi się z 0,4-2,0 M roztworem cyklobutenonu w toluenie ogrzanym do 80-160°C z niewielkim nadmiarem cyklobutenonu. Po dodaniu alkinu cykloaddycja [2+2] . Surowy produkt pierścieniowania traktuje się 10% wodorotlenkiem potasu w metanolu w celu zmydlenia estrowego produktu ubocznego utworzonego w reakcji produktu fenolowego z nadmiarem winyloketenu (Schemat 6).
W przypadku reakcji drugiej generacji rozpoczynającej się od diazoketonu, reakcję prowadzi się przez napromieniowanie 0,7 M roztworu ketonu z 1,0-1,2 równoważnika acetylenu. Niskociśnieniowa lampa rtęciowa o długości fali 254 nm w reaktorze fotochemicznym jest używana przez 5–8 godzin, aż do całkowitego zużycia diazoketonu, co określono za pomocą analizy TLC . Dichlorometan , chloroform i 1,2-dichloroetan są odpowiednimi rozpuszczalnikami do reakcji anulowania.
Preparaty odczynników
Cyklobutenon został pierwotnie zsyntetyzowany z prekursorów 3-bromocyklobutanonu i 3-chlorocyklobutanonu, które zostały przygotowane z allenu i ketenu dwiema niezależnymi drogami. Schemat 7 przedstawia wytwarzanie cyklobutenonu z allenu.
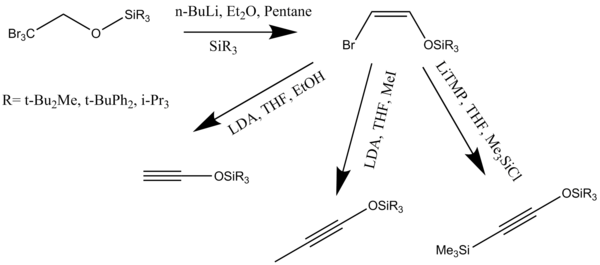
Aktywowane alkoksyacetyleny można zsyntetyzować w jednonaczyniowym preparacie triizopropylosililooksyacetylenów z estrów. Sililoksyacetyleny są użytecznymi substytutami alkoksyacetylenów w reakcjach [2 + 2] cykloaddycji z ketenami i winyloketenami dającymi cyklobuteny (Schemat 8).
Diazoketony można syntetyzować jednoetapowo z łatwo dostępnych ketonów lub prekursorów kwasu karboksylowego przez dodanie diazometanu do chlorków acylu. Metodę przeniesienia grupy diazowej można zastosować do wytworzenia α, β-nienasyconych ketonów. Tradycyjna metoda deformylacyjnego transferu diazo została ulepszona przez zastąpienie etapu formylowania Claisena trifluoroacetylowaniem wygenerowanych enolanów litu . Kluczowym etapem w tej procedurze jest aktywacja wyjściowego materiału ketonowego do odpowiedniej pochodnej α-trifluoroacetylowej przy użyciu trifluoroetylotrifluorooctanu (TFEA) (Schemat 9).
Alkiny lub ketenofile można syntetyzować różnymi metodami. Trialkilosililooksyalkiny okazały się doskonałymi ketenofilami. Alkiny te reagują w reakcji anulowania, tworząc etery monosililowe rezorcyny , które można usunąć z grupy zabezpieczającej w łagodnych warunkach reakcji. Promowana zasadą dehydrohalogenacja eterów (Z)-2-halowinylu z wytworzeniem alkoksyacetylenów jest jedną z najlepiej poznanych dróg syntezy alkinów (Schemat 10).
Zsyntetyzowane alkiny są następnie podgrzewane w benzenie lub toluenie w obecności nadmiaru cyklobutenonu inicjującego reakcję benzannulacji. Traktowanie n-Bu4NF w tetrahydrofuranie usuwa grupy siloksylowe z utworzeniem pożądanych dioli.
Zakres
Etery alkinylowe i siloksyacetyleny okazały się idealną parą do pierścieni aromatycznych. Reakcje można prowadzić zarówno z aktywowanymi heteropodstawionymi alkinami, jak i nieaktywowanymi acetlyenami. Tioetery alkinylowe i ynaminy były używane jako reagenty w reakcji anulowania.
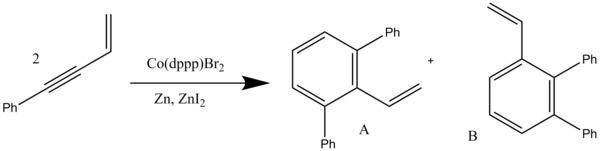
Sprzężone enyny były również używane w reakcjach benzannulacji katalizowanych przez kobalt . Ten rodzaj benzannulacji obejmuje cykloaddycję [4+2], po której następuje przesunięcie 1,3-wodoru. W dichlorometanie otrzymuje się produkty symetrycznej benzanulacji, natomiast w tetrahydrofuranie (THF) produkty niesymetrycznej benzanulacji uzyskuje się z dobrą regioselektywnością. Reakcje te wykorzystują 1,3-bis(difenylofosfino)propanem (dppp) w obecności sproszkowanego cynku i jodku cynku dla zależnej od rozpuszczalnika reakcji benzannulacji (Schemat 11). W dichlorometanie stosunek A:B wynosi 78:22 z ogólną wydajnością 90%, aw THF stosunek zmienił się do 7:93 (A:B) z wydajnością łączną 85%.
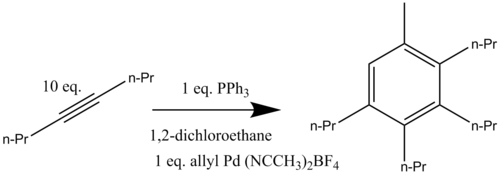
palladem benzanulacje zostały opracowane przy użyciu związków allilowych i alkinów. Ta katalizowana palladem reakcja została przeprowadzona zarówno w postaci międzycząsteczkowej, jak i wewnątrzcząsteczkowej. Kationowy kompleks palladu [(η 3 -C 3 H 5 )Pd(CH 3 CN) 2 ](BF 4 ) reaguje z nadmiarem 4- oktynu po podgrzaniu do 80 °C w obecności trifenylofosfiny tworząc związek aromatyczny 1 -metylo-2,3,4,5-tetrapropylobenzen (Schemat 12). Stwierdzono, że obecność dokładnie jednego równoważnika katalizatora palladowego ( z którego grupa allilowa dodaje się do końcowej struktury aromatycznej) jest kluczowa dla przebiegu katalizowanej benzannulacji z dobrą wydajnością .
Tę katalizowaną reakcję zoptymalizowano również dla substratów allilowych z katalitycznym [Pd2 ( dba) 3 ]CHCl3 i trifenylofosfiną (dba = dibenzylidenoaceton ) (Schemat 13).
Zastosowania w Totalnej Syntezie
Kwas mykofenolowy jest metabolitem Penicillium , który został pierwotnie przygotowany na kluczowym etapie benzannulacji. Alkin i cyklobutenon poddano reakcji z wytworzeniem podstawionego fenolu w jednym etapie z wydajnością 73% (Schemat 14). Kwas mykofenolowy przygotowano w dziewięciu etapach z całkowitą wydajnością 17-19%.
W syntezie silnie podstawionych indoli przeprowadzonej przez Danheisera kluczowym etapem była reakcja benzannulacji z użyciem cyklobutenonu i ynamidów w celu wytworzenia silnie podstawionych pochodnych aniliny . W tym przypadku orto może być funkcjonalizowana różnymi podstawnikami. Po reakcji benzannulacji z różnymi reakcjami heterocyklizacji można uzyskać dostęp do podstawionych indoli (Schemat 15).
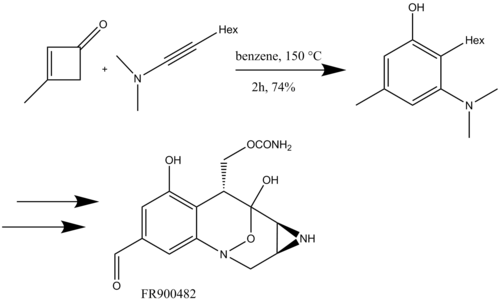
Danheiser zastosował również benzannulację z ynamidami do syntezy policyklicznych heterocyklicznych związków azotu skondensowanych z benzo, a następnie metatezę z zamknięciem pierścienia (schemat 16) do całkowitej syntezy (+)-FR900482, czynnika przeciwnowotworowego.
Kowalski po raz pierwszy zastosował reakcję benzannulacji z siloksyacetylenami, poddając je reakcji z cyklobutenonami w celu syntezy podstawionego fenolu do całkowitej syntezy Δ-6- tetrahydrokannabinolu (Schemat 17).
Reakcja benzannulacji została wykorzystana przez Smitha w całkowitej syntezie cylindrocyklofanów , w szczególności (-) -cylindrocyklofanu F. Wykorzystał reakcję siloksyalkinu i cyklobutenonu do skonstruowania dihydroksylowego aromatycznego związku pośredniego do reakcji metatezy olefin w celu uzyskania dostępu do celu (Schemat 18) .
Wybitne zastosowanie benzanulacji Danheisera w 6-etapowej syntezie dictyodendrins wykazali Zhang i Ready. Substrat cyklobutenonu uzyskali stosując hetero-[2+2]cykloaddycję między eterami arylowo-ynolowymi ( ketenu arylowego ), a następująca po nim benzannulacja umożliwiła szybkie zbudowanie karbazolowego łańcucha dictyodendrin F, H i I. Pomyślne wykorzystanie Danheisera benzannulacja pozwala Zhang i Ready na osiągnięcie najkrótszej jak dotąd syntezy naturalnych produktów dictyodendrin.