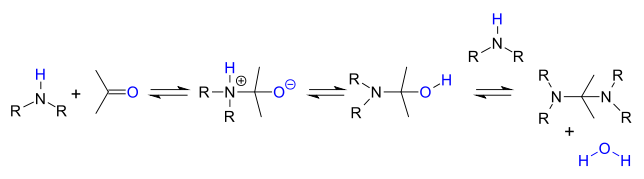Alkilomino-de-okso-bipodstawienie
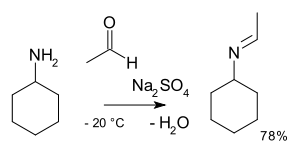
W chemii organicznej alkiloimino-de-okso-bisubstytucja to organiczna reakcja związków karbonylowych z aminami na iminy . Nazwa reakcji jest oparta na nomenklaturze transformacji IUPAC . Reakcja jest katalizowana kwasem , a typ reakcji to nukleofilowa addycja aminy do związku karbonylowego, a następnie przeniesienie protonu z azotu na tlen do stabilnego hemiaminalu lub karbinoloaminy. W przypadku amin pierwszorzędowych woda jest tracona w reakcji eliminacji do iminy . Z arylaminami tworzą się szczególnie stabilne zasady Schiffa .
Mechanizm reakcji
Etapy reakcji są reakcjami odwracalnymi , a reakcja jest doprowadzana do końca przez usunięcie wody, np. przez destylację azeotropową , sita molekularne lub tetrachlorek tytanu . Pierwszorzędowe aminy reagują poprzez niestabilny półaminowy , który następnie odszczepia wodę.
Aminy drugorzędowe nie tracą łatwo wody, ponieważ nie mają dostępnego protonu i zamiast tego często reagują dalej z aminalem :
lub gdy proton α-karbonylowy jest obecny w enaminie :
W środowisku kwaśnym produktem reakcji jest sól iminiowa powstająca w wyniku utraty wody.
Ten typ reakcji występuje w wielu preparatach heterocyklicznych , na przykład w reakcji Povarova i syntezie Friedländera z chinolinami .
Ponieważ oba składniki są tak reaktywne, cząsteczka nie zawiera jednocześnie grupy aldehydowej i aminowej, chyba że grupa aminowa jest wyposażona w grupę ochronną . Jako dalszą demonstrację reaktywności, w jednym badaniu zbadano właściwości α- formyloazyrydyny , która , jak stwierdzono, dimeryzuje jako oksazolidyna podczas tworzenia z odpowiedniego estru przez redukcję organiczną za pomocą DIBAL :
Tworzenie jonów iminiowych jest zabronione w tej cząsteczce, ponieważ mówi się, że grupa azyrydynowa i grupa formylowa są ortogonalne .
Zakres
W jednym potencjalnym zastosowaniu p - aminoaldehyd cynamonowy jest w stanie odróżnić cysteinę od homocysteiny . W przypadku cysteiny buforowany wodny roztwór aldehydu zmienia kolor z żółtego na bezbarwny w wyniku wtórnej reakcji zamknięcia pierścienia iminy. Homocysteina nie jest w stanie zamknąć pierścienia, a kolor się nie zmienia.
Linki zewnętrzne
- reakcja benzaldehydu i metyloaminy w Organic Syntheses Coll. Tom. 10, str. 312 (2004); Tom. 76, s. 23 (1999). Artykuł w Internecie
- reakcja metylobenzyloaminy z 2-metylocykloheksanonem w: Organie Syntheses , Coll. Tom. 9, s. 610 (1998); Tom. 70, s. 35 (1992). Artykuł
- Reakcja acetofenonu z metyloaminą w Organie Syntheses , Coll. Tom. 6, str. 818 (1988); Tom. 54, s. 93 (1974). Artykuł
- Chiralna zasada Schiffa w Molbank 2005, M435 Artykuł