Rozwój leków na COVID-19
| Część serii o |
| pandemii COVID-19 |
|---|
|
|
|
Opracowywanie leków na COVID-19 to proces badawczy mający na celu opracowanie profilaktycznych terapeutycznych leków na receptę , które złagodziłyby ciężkość choroby wywołanej przez koronawirusa 2019 (COVID-19). Od początku 2020 do 2021 roku kilkaset firm farmaceutycznych , firm biotechnologicznych , uniwersyteckich grup badawczych i organizacji zdrowotnych opracowywało kandydatów terapeutycznych na chorobę COVID-19 na różnych etapach badań przedklinicznych lub klinicznych (łącznie 506 kandydatów w kwietniu 2021 r.), z 419 potencjalnymi Leki na COVID-19 w badaniach klinicznych , stan na kwiecień 2021 r.
Już w marcu 2020 r. Światowa Organizacja Zdrowia (WHO), Europejska Agencja Leków (EMA), Amerykańska Agencja ds. Żywności i Leków (FDA) oraz chiński rząd i producenci leków koordynowali współpracę z naukowcami akademickimi i przemysłowymi w celu przyspieszenia opracowywania szczepionek, leki przeciwwirusowe i terapie poinfekcyjne. Międzynarodowa Platforma Rejestru Badań Klinicznych WHO zarejestrowała 536 badań klinicznych w celu opracowania terapii poinfekcyjnych dla zakażeń COVID-19, z wieloma uznanymi związkami przeciwwirusowymi do leczenia innych infekcji w ramach badań klinicznych, które mają zostać zmienione .
W marcu 2020 r. WHO zainicjowała „ Próbę SOLIDARNOŚCI ” w 10 krajach, do której włączono tysiące osób zakażonych COVID-19 w celu oceny efektów leczenia czterech istniejących związków przeciwwirusowych o najbardziej obiecującej skuteczności. Dynamiczny, systematyczny przegląd został ustanowiony w kwietniu 2020 r. w celu śledzenia postępów zarejestrowanych badań klinicznych szczepionki COVID-19 i potencjalnych leków terapeutycznych.
Rozwój leku to proces wieloetapowy, zwykle wymagający więcej niż pięciu lat, aby zapewnić bezpieczeństwo i skuteczność nowego związku. Kilka krajowych agencji regulacyjnych, takich jak EMA i FDA, zatwierdziło procedury mające na celu przyspieszenie badań klinicznych. Do czerwca 2021 r. dziesiątki potencjalnych terapii poinfekcyjnych znajdowało się w końcowej fazie testów na ludziach – badaniach klinicznych fazy III–IV . Według ostatnich Jefferies & Co, skuteczna, wygodna terapia COVID-19 może osiągnąć roczną sprzedaż na poziomie ponad 10 miliardów dolarów .
Tło
|
|
Opracowywanie leków to proces wprowadzania na rynek nowej szczepionki przeciwko chorobie zakaźnej lub leku terapeutycznego po zidentyfikowaniu wiodącego związku w procesie odkrywania leku . Obejmuje badania laboratoryjne na mikroorganizmach i zwierzętach, składanie wniosków o status regulacyjny, na przykład za pośrednictwem FDA, w celu rozpoczęcia badań klinicznych na ludziach, i może obejmować etap uzyskiwania zgody regulacyjnej wraz z wnioskiem o nowy lek w celu wprowadzenia go na rynek . Cały proces – od koncepcji, przez badania przedkliniczne w laboratorium, do opracowania badania klinicznego, w tym badań fazy I–III – do zatwierdzenia szczepionki lub leku zwykle trwa ponad dekadę.
Termin „badania przedkliniczne” definiuje się jako badania laboratoryjne in vitro i in vivo , wskazujące na początkowy etap opracowywania szczepionki zapobiegawczej, leku przeciwwirusowego lub innych terapii poinfekcyjnych, takich jak eksperymenty mające na celu określenie skutecznych dawek i toksyczności u zwierząt, przed kandydat na związek jest zaawansowany pod kątem oceny bezpieczeństwa i skuteczności u ludzi. Ukończenie przedklinicznego etapu opracowywania leku – a następnie przetestowanie go pod kątem bezpieczeństwa i skuteczności na odpowiedniej liczbie osób zakażonych COVID-19 (setki do tysięcy w różnych krajach) – to proces, który prawdopodobnie zajmie 1–2 lata w przypadku COVID-19 według kilku raportów z początku 2020 r. Pomimo tych wysiłków wskaźnik sukcesu kandydatów na leki w celu uzyskania ostatecznego zatwierdzenia przez organy regulacyjne w całym procesie opracowywania leku do leczenia chorób zakaźnych wynosi zaledwie 19%.
Badania fazy I dotyczą przede wszystkim bezpieczeństwa i wstępnego dawkowania u kilkudziesięciu zdrowych osób, natomiast badania fazy II – po sukcesie w fazie I – oceniają skuteczność terapeutyczną przeciwko chorobie COVID-19 przy rosnących poziomach dawek (skuteczność oparta na biomarkerach), przy ścisłej ocena możliwych działań niepożądanych proponowanej terapii (lub terapii skojarzonych), zazwyczaj u setek osób. Powszechny projekt badań fazy II możliwych leków na COVID-19 jest randomizowany , kontrolowany placebo , zaślepiony i prowadzony w wielu ośrodkach, przy jednoczesnym określeniu bardziej precyzyjnych, skutecznych dawek i monitorowaniu działań niepożądanych.
Wskaźnik sukcesu badań fazy II prowadzących do fazy III (dla wszystkich chorób) wynosi około 31%, a konkretnie dla chorób zakaźnych około 43%. W zależności od czasu jego trwania (dłuższy jest droższy) – zwykle od kilku miesięcy do dwóch lat – przeciętna długość badania fazy II kosztuje 57 mln USD (dolary z 2013 r., w tym koszty przedkliniczne i fazy I). Pomyślne ukończenie badania fazy II nie stanowi wiarygodnej prognozy, czy lek kandydujący odniesie sukces w badaniach fazy III.
Badania fazy III dotyczące COVID-19 obejmują setki do tysięcy hospitalizowanych uczestników i testują skuteczność leczenia w celu zmniejszenia skutków choroby, jednocześnie monitorując działania niepożądane przy optymalnej dawce, tak jak w międzynarodowych badaniach Solidarity i Discovery.
Kandydaci
Według jednego źródła (stan na sierpień 2020 r.) różne kategorie przedklinicznych lub wczesnych etapów badań klinicznych w celu opracowania kandydatów na leki na COVID-19 obejmowały:
- przeciwciała (81 kandydatów)
- leki przeciwwirusowe (31 kandydatów)
- związki komórkowe (34 kandydatów)
- RNA (6 kandydatów)
- skanowanie związków do zmiany przeznaczenia (18 kandydatów)
- różne inne kategorie terapii, takie jak przeciwzapalne, przeciwmalaryczne , interferonowe , oparte na białkach, antybiotyki i związki modulujące receptory .
Kluczowe badania III fazy oceniają, czy kandydat na lek jest skuteczny w konkretnej chorobie, a w przypadku osób hospitalizowanych z powodu ciężkiego zakażenia COVID-19 – sprawdzają poziom skutecznej dawki leku o zmienionym przeznaczeniu lub nowego kandydata na lek, aby złagodzić chorobę (głównie zapalenie płuc) z zakażenia COVID-19. W przypadku już zatwierdzonego leku (takiego jak hydroksychlorochina na malarię), badania fazy III-IV określają u setek do tysięcy osób zakażonych COVID-19 możliwe przedłużone stosowanie już zatwierdzonego leku do leczenia zakażenia COVID-19. Według stanu na sierpień 2020 r. ponad 500 potencjalnych środków terapeutycznych znajdowało się w fazie przedklinicznej lub na etapie rozwoju fazy I – IV, a nowe badania fazy II – III ogłoszono dla setek kandydatów terapeutycznych w 2020 r.
Liczne kandydujące leki badane jako „wspomagające” terapie łagodzące dyskomfort podczas choroby, takie jak NLPZ lub leki rozszerzające oskrzela , nie zostały uwzględnione w poniższej tabeli. Inni uczestnicy badań fazy II we wczesnym stadium lub liczni kandydaci do leczenia w badaniach fazy I również są wykluczeni. Kandydaci na leki w badaniach fazy I-II mają niski wskaźnik powodzenia (poniżej 12%), aby przejść przez wszystkie fazy badań, aby uzyskać ostateczne zatwierdzenie. Po przejściu do III fazy badań kandydaci terapeutyczni na choroby związane z zakażeniem COVID-19 – choroby zakaźne i układu oddechowego – mają wskaźnik sukcesu wynoszący około 72%.
| Kandydat na lek | Opis | Zatwierdzenie istniejącej choroby | Sponsorzy próbni | Lokalizacja(e) | Oczekiwane rezultaty |
Notatki, referencje |
|---|---|---|---|---|---|---|
| Remdesiwir | przeciwwirusowe ; analog nukleotydu adenozyny hamujący syntezę RNA u koronawirusów | dochodzeniowy | Gilead , WHO, INSERM , NIAID | Chiny, Japonia początkowo; rozszerzony na arenie międzynarodowej w Global Solidarity and Discovery Trials oraz US NIAID ACTT Trial | Połowa 2020 r. (próby chińskie, japońskie) | selektywnie udostępniane przez Gilead na potrzeby dostępu awaryjnego w związku z COVID-19; zarówno obiecujące, jak i negatywne skutki odnotowano w kwietniu |
| Hydroksychlorochina lub chlorochina | przeciwpasożytnicze i przeciwreumatyczne ; generyczne produkowane przez wielu producentów | malaria , reumatoidalne zapalenie stawów, toczeń (międzynarodowy) | CEPI, WHO, INSERM | Wiele witryn w Chinach; globalne próby Solidarity i Discovery | Czerwiec 2020 (wycofany przez WHO) | liczne skutki uboczne ; możliwe niepożądane interakcje leków na receptę ; wycofane w czerwcu z badania WHO Solidarity i badania UK Recovery jako „nie przynoszące korzyści klinicznych u hospitalizowanych pacjentów z COVID-19”; próby |
| Fawipirawir | przeciwwirusowe przeciwko grypie | grypa (Chiny) | Fujifilm | Chiny | kwiecień 2020 r | |
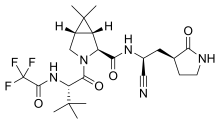
| Lopinawir/rytonawir bez lub z interferonem beta-1a | przeciwwirusowe, immunosupresyjne | kombinacja badawcza; zatwierdzony lopinawir/rytonawir | CEPI, WHO, rząd Wielkiej Brytanii, Univ. z Oksfordu, INSERM | Global Solidarity and Discovery Trials, wiele krajów | połowa 2020 r | |
| Sarilumab | ludzkie przeciwciało monoklonalne przeciwko receptorowi interleukiny-6 | reumatoidalne zapalenie stawów (USA, Europa) | Regeneron - Sanofi | Wiele krajów | Wiosna 2020 | |
| ASC-09 + rytonawir | środek przeciwwirusowy | kombinacja niezatwierdzona; rytonawir zatwierdzony dla HIV | Ascletis Pharma | Wiele witryn w Chinach | Wiosna 2020 | |
| Tocilizumab | ludzkie przeciwciało monoklonalne przeciwko receptorowi interleukiny-6 | immunosupresja, reumatoidalne zapalenie stawów (USA, Europa) | Genentech - Hoffmann-La Roche | Wiele krajów | połowa 2020 r | Firma Roche ogłosiła pod koniec lipca, że jej badanie fazy III tocilizumabu w leczeniu zapalenia płuc u hospitalizowanych osób z zakażeniem COVID-19 było nieskuteczne |
| Lenzilumab | humanizowane przeciwciało monoklonalne do łagodzenia zapalenia płuc | nowy kandydat na lek | Humanigen, Inc. | Wiele witryn w Stanach Zjednoczonych | wrzesień 2020 r | |
| Dapagliflozyna | inhibitor kotransportera sodowo-glukozowego 2 | środek hipoglikemizujący | Instytut Serca Ameryki Środkowej św. Łukasza, AstraZeneca | Wiele krajów | grudzień 2020 r | |
| CD24Fc | immunomodulator przeciwwirusowy przeciwko odpowiedzi zapalnej | nowy kandydat na lek | Onco Immune, Inc. | Wiele witryn w Stanach Zjednoczonych | 2021 | |
| apabetalon | selektywny inhibitor BET | dochodzeniowy | Resverlogix Corp | Stany Zjednoczone | 22 marca 2022 r |
Kandydaci na leki o zmienionym przeznaczeniu
Repozycjonowanie leków (zwane również zmianą przeznaczenia leków) – badanie istniejących leków pod kątem nowych celów terapeutycznych – to jeden z kierunków badań naukowych prowadzonych w celu opracowania bezpiecznych i skutecznych metod leczenia COVID-19. Kilka istniejących leków przeciwwirusowych, wcześniej opracowanych lub stosowanych w leczeniu zespołu ciężkiej ostrej niewydolności oddechowej (SARS), bliskowschodniego zespołu oddechowego (MERS), HIV/AIDS i malarii , jest obecnie badanych jako leczenie COVID-19, a niektóre z nich przechodzą do badań klinicznych .
Podczas pandemii COVID-19 zmiana przeznaczenia leku to proces badań klinicznych polegający na szybkim badaniu przesiewowym i określaniu bezpieczeństwa i skuteczności istniejących leków, które zostały już zatwierdzone w leczeniu innych chorób i mają być stosowane u osób z zakażeniem COVID-19. W zwykłym procesie opracowywania leków potwierdzenie zmiany przeznaczenia leku na nowe leczenie wymagałoby wielu lat badań klinicznych – w tym kluczowych badań klinicznych fazy III – nad kandydatem na lek, aby zapewnić jego bezpieczeństwo i skuteczność, szczególnie w leczeniu zakażenia COVID-19. W nagłym przypadku narastającej pandemii COVID-19 proces zmiany przeznaczenia leku został przyspieszony w marcu 2020 r. w celu leczenia osób hospitalizowanych z powodu COVID-19.
Badania kliniczne z użyciem zmodyfikowanych, ogólnie bezpiecznych, istniejących leków dla hospitalizowanych osób z COVID-19 mogą zająć mniej czasu i obniżyć ogólne koszty w celu uzyskania punktów końcowych potwierdzających bezpieczeństwo (brak poważnych skutków ubocznych) i skuteczność po zakażeniu, a także mogą uzyskać szybki dostęp do istniejących zasobów leków sieci do produkcji i dystrybucji na całym świecie. W ramach międzynarodowych wysiłków zmierzających do uchwycenia tych zalet WHO rozpoczęła w połowie marca 2020 r. przyspieszone międzynarodowe badania fazy II–III dotyczące czterech obiecujących opcji leczenia – badanie SOLIDARITY – z licznymi innymi lekami, które mogą znaleźć zastosowanie w różnych strategiach leczenia chorób, takich jak między innymi terapie przeciwzapalne, kortykosteroidowe , przeciwciała, immunologiczne i czynniki wzrostu , przechodzące do badań fazy II lub III w 2020 r.
W marcu 2020 roku Amerykańskie Centrum Kontroli i Zapobiegania Chorobom (CDC) wydało zalecenie dla lekarzy dotyczące remdesiviru dla osób hospitalizowanych z powodu zapalenia płuc wywołanego przez COVID-19: „Chociaż badania kliniczne mają kluczowe znaczenie dla ustalenia bezpieczeństwa i skuteczności tego leku, klinicyści bez dostępu do badania klinicznego może zażądać od producenta remdesiviru do użytku osobistego u pacjentów z klinicznym zapaleniem płuc”.
Nowe leki przeciwciałowe
Plazma rekonwalescentów
Zaproponowano bierną immunizację osoczem rekonwalescentów lub surowicą hiperimmunizowaną jako potencjalne leczenie COVID-19. Według stanu na maj 2021 r. istnieją mocne dowody na to, że leczenie osoczem rekonwalescentów nie wiąże się z poprawą kliniczną u osób z umiarkowaną lub ciężką chorobą i nie zmniejsza ryzyka zgonu. Potencjalne działania niepożądane związane z leczeniem osoczem rekonwalescentów nie są znane.
W Stanach Zjednoczonych FDA udzieliła tymczasowego zezwolenia na osocze rekonwalescentów (osocze z krwi osób, które wyzdrowiały z COVID-19, zawierające w związku z tym przeciwciała przeciwko SARS-CoV-2) jako leczenie eksperymentalne w przypadkach, gdy życie danej osoby jest poważnie lub bezpośrednio zagrożone. Według stanu na maj 2021 r. w recenzowanych czasopismach medycznych opublikowano co najmniej 12 randomizowanych badań kontrolowanych dotyczących skuteczności leczenia osoczem rekonwalescentów. Ponadto według stanu na maj 2021 r. 100 dodatkowych badań było „w toku”, a 33 badania zgłoszono jako „konkurujące”, ale jeszcze nieopublikowane.
Argentyna, Brazylia, Kostaryka i Meksyk kontynuowały rozwój antysurowic . W połowie 2020 r. Brazylia rozpoczęła prace nad końską surowicą hiperimmunizacyjną, uzyskaną przez zaszczepienie koni rekombinowanym białkiem szczytowym SARS-CoV-2. Konsorcjum Instituto Vital Brazil, UFRJ , Fundacji Oswaldo Cruz i D'Or Institute for Research and Education w Rio de Janeiro rozpoczęło badania przedkliniczne w maju 2020 r., a Instituto Butantan w São Paulo zakończyło testy na zwierzętach we wrześniu. W grudniu 2020 r. Argentyna wydała awaryjne zezwolenie na CoviFab, lokalnie opracowany preparat końskiej surowicy hiperimmunologicznej, do stosowania w przypadkach umiarkowanego do ciężkiego COVID-19, w oparciu o wstępne wyniki pojedynczego badania fazy 2/3, które sugerowało zmniejszenie śmiertelności , przyjęcie na OIOM i wymagania dotyczące wentylacji mechanicznej u pacjentów, którzy otrzymali surowicę. Zostało to ostro skrytykowane przez Argentyńskie Towarzystwo Intensywnej Terapii, które stwierdziło, że w badaniu nie osiągnięto pierwszorzędowych ani drugorzędowych punktów końcowych i nie wykazano żadnych statystycznie istotnych różnic między grupami otrzymującymi surowicę i placebo.
Bamlanivimab/etesevimab
Bamlanivimab/etesevimab to połączenie dwóch przeciwciał monoklonalnych , bamlanivimabu i etesevimabu , podawane razem we wlewie dożylnym w leczeniu COVID-19 . Oba typy przeciwciał celują w białko szczytowe SARS -CoV-2 .
Bamlanivimab i etesevimab, podawane razem, są dopuszczone w Stanach Zjednoczonych do leczenia łagodnego do umiarkowanego COVID-19 u osób w wieku 12 lat i starszych, ważących co najmniej 40 kilogramów (88 funtów) z pozytywnym wynikiem bezpośredniego zakażenia SARS- testów na obecność wirusa CoV-2 i którzy są narażeni na wysokie ryzyko progresji do ciężkiego COVID-19, w tym hospitalizacji lub śmierci. Są również dopuszczone, jeśli są podawane razem, do stosowania po ekspozycji na wirusa SARS-CoV-2 w profilaktyce poekspozycyjnej (PEP) dla COVID-19 i nie są dopuszczone do profilaktyki przedekspozycyjnej w celu zapobiegania COVID-19 przed narażeniem na wirusa SARS-CoV-2.
W styczniu 2022 r. amerykańska Agencja ds. Żywności i Leków (FDA) dokonała przeglądu zezwoleń na dwie terapie przeciwciałami monoklonalnymi – bamlanivimab/etesevimab (podawane razem) i casirivimab/imdevimab – w celu ograniczenia ich stosowania tylko wtedy, gdy biorcy prawdopodobnie zostali zakażeni lub narażonych na wariant, który jest podatny na te zabiegi. Ponieważ dane wskazują, że jest bardzo mało prawdopodobne, aby te terapie były skuteczne przeciwko wariantowi omicron, który krąży z bardzo dużą częstotliwością w całych Stanach Zjednoczonych, te terapie nie są obecnie dopuszczone do stosowania w żadnych stanach, terytoriach i jurysdykcjach USA.bebtelowimab
Bebtelowimab to przeciwciało monoklonalne opracowane przez AbCellera i Eli Lilly jako lek na COVID-19 .
Możliwe działania niepożądane obejmują swędzenie, wysypkę, reakcje związane z infuzją, nudności i wymioty.
Bebtelowimab działa poprzez wiązanie się z białkiem szczytowym wirusa, który powoduje COVID-19, podobnie jak inne przeciwciała monoklonalne, które zostały dopuszczone do leczenia osób z grupy wysokiego ryzyka z łagodnym do umiarkowanego COVID-19 i wykazały korzyści w zmniejszaniu ryzyka hospitalizacja lub śmierć. Bebtelowimab jest neutralizującym ludzkim przeciwciałem monoklonalnym G1 (IgG1), wyizolowanym od pacjenta, który wyzdrowiał z choroby koronawirusowej 2019 (COVID-19), skierowanej przeciwko białku kolca (S) koronawirusa-2 zespołu ostrej niewydolności oddechowej (SARS- CoV-2), które potencjalnie mogą być wykorzystane do uodpornienia przeciwko COVID-19.
Od listopada 2022 r. bebtelowimab nie jest dopuszczony do stosowania w nagłych wypadkach w USA, ponieważ nie oczekuje się, że zneutralizuje podwarianty Omicron BQ.1 i BQ.1.1.Casirivimab/imdevimab
Casirivimab/imdevimab , sprzedawany między innymi pod marką REGEN‑COV, to lek złożony stosowany w leczeniu i profilaktyce COVID‑19 . Składa się z dwóch ludzkich przeciwciał monoklonalnych , kasiriwimabu i imdewimabu, które należy zmieszać i podać we wlewie lub wstrzyknięciu podskórnym. Połączenie dwóch przeciwciał ma zapobiegać ucieczce mutacji . Jest również dostępny jako złożony . Został opracowany przez amerykańską firmę biotechnologiczną Regeneron Pharmaceuticals .
Najczęstsze działania niepożądane obejmują reakcje alergiczne, w tym reakcje związane z infuzją, reakcje w miejscu wstrzyknięcia, krótkotrwały ból, osłabienie i inne.
Połączenie zostało zatwierdzone pod marką Ronapreve do użytku medycznego w Japonii, Wielkiej Brytanii, Unii Europejskiej i Australii.
W styczniu 2022 r. amerykańska Agencja ds. Żywności i Leków (FDA) dokonała przeglądu zezwoleń na dwie terapie przeciwciałami monoklonalnymi – bamlanivimab/etesevimab (podawane razem) i casirivimab/imdevimab – w celu ograniczenia ich stosowania tylko do sytuacji, gdy biorcy prawdopodobnie zostali zakażeni lub narażeni na wariant, który jest podatny na te zabiegi, ponieważ dane wskazują, że jest bardzo mało prawdopodobne, aby te zabiegi były aktywne przeciwko wariantowi omicron .Regdanwimab
Regdanvimab , sprzedawany pod marką Regkirona, to ludzkie przeciwciało monoklonalne stosowane w leczeniu COVID-19 . Przeciwciało jest skierowane przeciwko białku szczytowemu SARS -CoV-2 . Jest rozwijany przez firmę Celltrion . Lek podaje się we wlewie dożylnym (kroplówce).
Najczęstsze działania niepożądane obejmują reakcje związane z infuzją, w tym reakcje alergiczne i anafilaksję.
Regdanvimab został dopuszczony do użytku medycznego w Unii Europejskiej w listopadzie 2021 roku.Sotrowimab
Sotrovimab , sprzedawany pod marką Xevudy, jest ludzkim neutralizującym przeciwciałem monoklonalnym o aktywności przeciwko koronawirusowi zespołu ostrej niewydolności oddechowej 2, znanemu jako SARS-CoV-2 . Został opracowany przez GlaxoSmithKline i Vir Biotechnology, Inc. Sotrovimab ma łączyć się z białkiem kolca SARS-CoV-2.
Do najczęstszych działań niepożądanych należą reakcje nadwrażliwości (alergiczne) i reakcje związane z infuzją.
Chociaż Sotrovimab był stosowany na całym świecie przeciwko SARS-CoV-2, w tym w Stanach Zjednoczonych na podstawie zezwolenia FDA do użytku awaryjnego (EUA), FDA anulowała EUA w kwietniu 2022 r. Z powodu braku skuteczności przeciwko wariantowi Omicron .Tixagevimab/cilgavimab
Nowe inhibitory replikacji wirusów
Molnupirawir
Molnupirawir , sprzedawany pod marką Lagevrio, jest lekiem przeciwwirusowym , który hamuje replikację niektórych wirusów RNA . Jest stosowany w leczeniu COVID-19 u osób zakażonych SARS-CoV-2 . Przyjmuje się go doustnie .
Molnupirawir jest prolekiem syntetycznej pochodnej nukleozydowej N4 - hydroksycytydyny i wykazuje działanie przeciwwirusowe poprzez wprowadzanie błędów kopiowania podczas replikacji wirusowego RNA .
Molnupirawir został pierwotnie opracowany do leczenia grypy na Uniwersytecie Emory przez uniwersytecką firmę zajmującą się innowacjami farmaceutycznymi, Drug Innovation Ventures at Emory (DRIVE), ale podobno został porzucony z powodu obaw o mutagenność . Następnie został przejęty przez firmę Ridgeback Biotherapeutics z siedzibą w Miami , która później nawiązała współpracę z Merck & Co. w celu dalszego rozwoju leku.
Na podstawie pozytywnych wyników kontrolowanych placebo , podwójnie ślepych , randomizowanych badań klinicznych, molnupirawir został dopuszczony do użytku medycznego w Wielkiej Brytanii w listopadzie 2021 r. W grudniu 2021 r. amerykańska Agencja ds. Żywności i Leków (FDA) przyznała zezwolenie na stosowanie w sytuacjach awaryjnych (EUA) na molnupirawir do stosowania w niektórych populacjach, w których inne metody leczenia nie są możliwe. Zezwolenie na stosowanie w nagłych wypadkach zostało zatwierdzone tylko wąsko (13-10) z powodu pytań dotyczących skuteczności i obaw, że mutagenne działanie molnupirawiru może stworzyć nowe warianty, które unikają odporności i przedłużają pandemię COVID- 19 .Nowe inhibitory proteazy
Enzytrelwir
Ensitrelvir , sprzedawany pod marką Xocova, to lek przeciwwirusowy stosowany w leczeniu COVID-19 . Został opracowany przez Shionogi we współpracy z Uniwersytetem Hokkaido i działa jako aktywny po podaniu doustnym inhibitor proteazy podobnej do 3C . Jest przyjmowany doustnie.
Do najczęstszych działań niepożądanych należą przejściowe spadki lipoprotein o dużej gęstości i wzrost trójglicerydów we krwi.Nirmatrelvir/ritonavir , sprzedawany pod marką Paxlovid, to pakowany lek doustny , opracowany przez firmę Pfizer i stosowany w leczeniu COVID-19 . Zawiera leki przeciwwirusowe nirmatrelwir i rytonawir .
Działania niepożądane nirmatrelwiru/rytonawiru obejmują zmiany w odczuwaniu smaku , biegunkę , wysokie ciśnienie krwi i ból mięśni . Ze względu na silne hamowanie CYP3A przez rytonawir nirmatrelwir z rytonawirem ma duże prawdopodobieństwo wystąpienia potencjalnie poważnych interakcji lekowych . Nirmatrelwir jest głównym inhibitorem proteazy SARS-CoV-2, podczas gdy rytonawir jest inhibitorem proteazy HIV-1 i silnym inhibitorem CYP3A. Nirmatrelwir odpowiada za przeciwwirusowe działanie leku na SARS-CoV-2, podczas gdy rytonawir działa poprzez hamowanie metabolizmu nirmatrelwiru i tym samym wzmacnianie jego działania.
W grudniu 2021 r. nirmatrelwir/rytonawir uzyskał zezwolenie na stosowanie w nagłych wypadkach przez Amerykańską Agencję ds. Żywności i Leków (FDA) w leczeniu COVID-19 . Nie jest dopuszczony do stosowania w przedekspozycyjnej i poekspozycyjnej COVID-19 ani do rozpoczynania leczenia osób wymagających hospitalizacji z powodu ciężkiego lub krytycznego przebiegu COVID-19. Został zatwierdzony w Wielkiej Brytanii pod koniec tego miesiąca, aw Unii Europejskiej i Kanadzie w styczniu 2022 r.Inny
sabizabulina

|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
[2-(1H - indol-3-ilo)-1H - imidazol-5-ilo]-(3,4,5-trimetoksyfenylo)metanon
|
|
| Inne nazwy VERU-111
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEMBL | |
| ChemSpider | |
| KEGG | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
|
|
|
| Nieruchomości | |
| C21H19N3O4 _ _ _ _ _ _ _ | |
| Masa cząsteczkowa | 377,400 g·mol -1 |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Planowanie i koordynacja
Wczesne planowanie
W latach 2018–2020 nowe inicjatywy mające na celu stymulowanie opracowywania szczepionek i leków przeciwwirusowych obejmowały partnerstwa między organizacjami rządowymi a przemysłem, takie jak European Innovative Medicines Initiative , amerykańska inicjatywa Critical Path Initiative mająca na celu zwiększenie innowacyjności w opracowywaniu leków oraz oznaczenie Breakthrough Therapy w celu przyspieszenia rozwoju oraz przegląd regulacyjny obiecujących leków kandydujących. Aby przyspieszyć udoskonalanie diagnostyki w celu wykrycia zakażenia COVID-19, utworzono globalny narzędzie do śledzenia potoków diagnostycznych.
Według podmiotu monitorującego postępy badań klinicznych nad potencjalnymi lekami terapeutycznymi na infekcje COVID-19, 29 badań skuteczności fazy II–IV zakończono w marcu 2020 r. 19 pod koniec 2019 r. Siedem badań oceniało leki o zmienionym przeznaczeniu, które zostały już zatwierdzone do leczenia malarii , w tym cztery badania dotyczące hydroksychlorochiny lub fosforanu chlorochiny. Większość chińskich badań obejmuje leki przeciwwirusowe o zmienionym przeznaczeniu, z 9 badaniami fazy III remdesiviru w kilku krajach, które mają zostać opublikowane do końca kwietnia. Inni potencjalni kandydaci terapeutyczni w ramach kluczowych badań klinicznych, które zakończą się w marcu-kwietniu, to między innymi leki rozszerzające naczynia krwionośne , kortykosteroidy , terapie immunologiczne , kwas liponowy , bewacyzumab i rekombinowany enzym konwertujący angiotensynę 2 .
COVID-19 Clinical Research Coalition ma na celu 1) ułatwienie szybkiego przeglądu propozycji badań klinicznych przez komisje etyczne i krajowe agencje regulacyjne, 2) szybką ścieżkę zatwierdzania potencjalnych związków terapeutycznych, 3) zapewnienie standaryzowanej i szybkiej analizy pojawiającej się skuteczności i danych dotyczących bezpieczeństwa oraz 4) ułatwić udostępnianie wyników badań klinicznych przed publikacją. Od kwietnia prowadzono dynamiczny przegląd rozwoju klinicznego szczepionki i leków na COVID-19.
Do marca 2020 r. Międzynarodowa Koalicja na rzecz Innowacji w zakresie gotowości na wypadek epidemii (CEPI) zobowiązała się do zainwestowania 100 mln USD w badania naukowe w kilku krajach i wystosowała pilne wezwanie do zebrania i szybkiego zainwestowania 2 mld USD na rozwój szczepionek. Prowadzony przez Fundację Billa i Melindy Gatesów wraz z partnerami inwestującymi 125 mln USD i współpracujący ze Światową Organizacją Zdrowia, COVID-19 Therapeutics Accelerator rozpoczął się w marcu, ułatwiając naukowcom zajmującym się opracowywaniem leków szybkie identyfikowanie, ocenianie, opracowywanie i zwiększanie skali potencjalnych metod leczenia . COVID-19 Clinical Research Coalition została utworzona w celu koordynowania i przyspieszania wyników międzynarodowych badań klinicznych nad najbardziej obiecującymi metodami leczenia poinfekcyjnego. Na początku 2020 r. wiele uznanych związków przeciwwirusowych do leczenia innych infekcji zostało zmienionych lub opracowanych w ramach nowych badań klinicznych w celu złagodzenia choroby COVID-19.
W marcu 2020 r. Koalicja na rzecz innowacji w zakresie gotowości na wypadek epidemii (CEPI) zainicjowała międzynarodowy fundusz rozwoju szczepionki przeciwko COVID-19, którego celem jest zebranie 2 miliardów USD na badania i rozwój szczepionek oraz zobowiązała się do zainwestowania 100 milionów USD w rozwój szczepionek w kilku Państwa. Rząd kanadyjski ogłosił finansowanie w wysokości 275 mln CA $ na 96 projektów badawczych dotyczących medycznych środków zaradczych przeciwko COVID-19, w tym wielu kandydatów na szczepionki na kanadyjskich uniwersytetach, z planami utworzenia „banku szczepionek” nowych szczepionek do wdrożenia w przypadku wystąpienia kolejnej epidemii COVID-19 . Fundacja Billa i Melindy Gatesów zainwestowała w kwietniu 150 mln USD w rozwój szczepionek, diagnostykę i terapie COVID-19.
Badania wspomagane komputerowo
W marcu 2020 r. Departament Energii Stanów Zjednoczonych , Narodowa Fundacja Nauki , NASA , przemysł i dziewięć uniwersytetów połączyły zasoby, aby uzyskać dostęp do superkomputerów IBM , w połączeniu z zasobami przetwarzania w chmurze Hewlett Packard Enterprise , Amazon , Microsoft i Google , w celu odkrywania leków . Konsorcjum COVID-19 High Performance Computing ma również na celu prognozowanie rozprzestrzeniania się choroby, modelowanie możliwych szczepionek i badanie tysięcy związków chemicznych w celu zaprojektowania szczepionki lub terapii COVID-19. Konsorcjum wykorzystało 437 peta FLOPS mocy obliczeniowej do maja 2020 r.
C3.ai Digital Transformation Institute, dodatkowe konsorcjum firmy Microsoft, sześciu uniwersytetów (w tym Massachusetts Institute of Technology , członek pierwszego konsorcjum) oraz National Center for Supercomputer Applications w Illinois, działające pod auspicjami C3.ai , firma zajmująca się oprogramowaniem sztucznej inteligencji, łączy zasoby superkomputerów w celu odkrywania leków, opracowywania protokołów medycznych i ulepszania strategii zdrowia publicznego, a także przyznaje duże granty naukowcom, którzy do maja zaproponowali wykorzystanie sztucznej inteligencji do wykonywania podobnych zadań.
W marcu 2020 r. projekt przetwarzania rozproszonego Folding@home uruchomił program mający pomóc twórcom leków, początkowo symulując cele białkowe z SARS-CoV-2 i powiązanego wirusa SARS-CoV, który był wcześniej badany.
Projekt przetwarzania rozproszonego Rosetta@home również dołączył do wysiłków w marcu. Projekt wykorzystuje komputery ochotników do modelowania białek wirusa SARS-CoV-2 w celu odkrycia potencjalnych celów leków lub stworzenia nowych białek neutralizujących wirusa. Naukowcy ujawnili, że z pomocą Rosetta@home byli w stanie „dokładnie przewidzieć strukturę ważnego białka koronawirusa w skali atomowej na kilka tygodni, zanim można było je zmierzyć w laboratorium”.
Rozpoczęło się partnerstwo OpenPandemics - COVID-19 między Scripps Research a IBM's World Community Grid . Partnerstwo to rozproszony projekt obliczeniowy, który „automatycznie przeprowadzi symulowany eksperyment w tle [podłączonych domowych komputerów PC], który pomoże przewidzieć skuteczność określonego związku chemicznego jako możliwego leczenia COVID-19”.
Międzynarodowe procesy solidarności i odkrycia
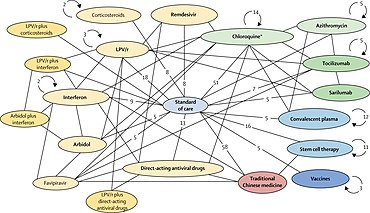
W marcu Światowa Organizacja Zdrowia (WHO) rozpoczęła skoordynowaną „Próbę Solidarności” w 10 krajach na pięciu kontynentach, aby szybko ocenić na tysiącach osób zakażonych COVID-19 potencjalną skuteczność istniejących środków przeciwwirusowych i przeciwzapalnych , które nie zostały jeszcze ocenione specjalnie pod kątem Covid-19 choroba. Pod koniec kwietnia w badaniu uczestniczyły szpitale w ponad 100 krajach.
Pojedyncze lub złożone leki poddawane wstępnym badaniom to 1) połączenie lopinawiru z rytonawirem , 2) połączenie lopinawiru z rytonawirem z interferonem beta , 3) remdesiwir lub 4) (hydroksy) chlorochina w oddzielnych badaniach i ośrodkach szpitalnych na całym świecie. Po badaniu opublikowanym przez The Lancet dotyczącym obaw związanych z bezpieczeństwem hydroksychlorochiny, WHO zawiesiła jej stosowanie w badaniu Solidarity w maju 2020 r., przywróciła je po wycofaniu badań, a następnie zaprzestała dalszego stosowania leku w leczeniu COVID-19, gdy analiza wykazała w czerwcu, że nie przyniosło to żadnych korzyści.
Ponieważ około 15% osób zakażonych COVID-19 ma ciężką chorobę, a szpitale są przeciążone podczas pandemii, WHO uznała szybką kliniczną potrzebę przetestowania i zmiany przeznaczenia tych leków jako środków już zatwierdzonych do leczenia innych chorób i uznanych za bezpieczne. Projekt Solidarity ma na celu zapewnienie szybkiego wglądu w kluczowe pytania kliniczne:
- Czy któryś z leków zmniejsza śmiertelność?
- Czy któryś z leków skraca czas hospitalizacji pacjenta?
- Czy terapie wpływają na konieczność wentylacji lub utrzymania osób z zapaleniem płuc wywołanym przez COVID-19 na oddziale intensywnej terapii ?
- Czy takie leki mogą być stosowane w celu zminimalizowania zachorowań na zakażenie COVID-19 u personelu medycznego i osób z dużym ryzykiem rozwoju ciężkiej choroby?
Rejestrację osób z zakażeniem COVID-19 można uprościć, wprowadzając dane, w tym świadomą zgodę , na stronie internetowej WHO. Po określeniu przez personel badania leków dostępnych w szpitalu strona internetowa WHO losowo przypisuje hospitalizowanemu pacjentowi jeden z badanych leków lub szpitalny standard opieki w leczeniu COVID-19. Lekarz prowadzący badanie rejestruje i przekazuje dalsze informacje dotyczące stanu pacjenta i leczenia, uzupełniając wprowadzanie danych za pośrednictwem strony internetowej WHO Solidarity. Projekt badania Solidarity nie jest podwójnie ślepy – co jest zwykle standardem w wysokiej jakości badaniu klinicznym – ale WHO potrzebowała szybkości i jakości badania w wielu szpitalach i krajach. Globalna rada monitorująca bezpieczeństwo lekarzy WHO bada tymczasowe wyniki , aby pomóc w podejmowaniu decyzji dotyczących bezpieczeństwa i skuteczności badanych leków oraz zmienić projekt badania lub zalecić skuteczną terapię. Podobne badanie internetowe do Solidarności, zatytułowane „Discovery”, zostało zainicjowane w marcu w siedmiu krajach przez INSERM ( Paryż, Francja ).
Próba Solidarity ma na celu wdrożenie koordynacji między setkami szpitali w różnych krajach – w tym tych o słabo rozwiniętej infrastrukturze do badań klinicznych – ale musi zostać przeprowadzona szybko. Według Johna-Arne Røttingena , dyrektora naczelnego Norweskiej Rady ds. Badań i przewodniczącego międzynarodowego komitetu sterującego Solidarity , badanie zostanie uznane za skuteczne, jeśli terapie będą zdeterminowane, aby „zmniejszyć odsetek pacjentów wymagających respiratorów o, powiedzmy, 20 %, co może mieć ogromny wpływ na nasze krajowe systemy opieki zdrowotnej”.
W marcu fundusze na proces Solidarności sięgnęły 108 mln USD od 203 000 osób, organizacji i rządów, z 45 krajów zaangażowanych w finansowanie lub zarządzanie procesem.
Projekt badania klinicznego w toku może zostać zmodyfikowany jako „projekt adaptacyjny”, jeśli gromadzone dane w badaniu zapewnią wczesny wgląd w pozytywną lub negatywną skuteczność leczenia. Globalne badania Solidarity i European Discovery z udziałem hospitalizowanych osób z ciężką infekcją COVID-19 wykorzystują projekt adaptacyjny, aby szybko zmieniać parametry badania, gdy pojawiają się wyniki czterech eksperymentalnych strategii terapeutycznych. Projekty adaptacyjne w ramach trwających badań klinicznych fazy II–III nad potencjalnymi lekami mogą skrócić czas trwania badań i obejmować mniejszą liczbę uczestników, prawdopodobnie przyspieszając decyzje o wcześniejszym zakończeniu lub sukcesie oraz koordynując zmiany projektu dla konkretnego badania w jego międzynarodowych lokalizacjach.
Adaptacyjna próba leczenia COVID-19
Amerykański Narodowy Instytut Alergii i Chorób Zakaźnych (NIAID) zainicjował adaptacyjne, międzynarodowe badanie fazy III (zwane „ACTT”), w którym wzięło udział do 800 hospitalizowanych osób z COVID-19 w 100 ośrodkach w wielu krajach. Począwszy od stosowania remdesiviru jako podstawowego leczenia przez 29 dni, próbna definicja jego adaptacyjnego protokołu stwierdza, że „będzie tymczasowe monitorowanie w celu wprowadzenia nowych ramion i umożliwienia wcześniejszego zaprzestania leczenia ze względu na daremność, skuteczność lub bezpieczeństwo. Jeśli okaże się, że jedna terapia jest skuteczne, to leczenie to może stać się grupą kontrolną do porównania z nowymi eksperymentalnymi metodami leczenia”.
Operacja Warp Speed
Operacja Warp Speed (OWS) to partnerstwo publiczno-prywatne zainicjowane przez rząd Stanów Zjednoczonych w celu ułatwienia i przyspieszenia rozwoju, produkcji i dystrybucji szczepionek , środków terapeutycznych i diagnostycznych przeciwko COVID-19 . Pierwsza wiadomość o operacji Warp Speed pojawiła się 29 kwietnia 2020 r., A program został oficjalnie ogłoszony 15 maja 2020 r. Kierował nim Moncef Slaoui od maja 2020 r. Do stycznia 2021 r. I David A. Kessler od stycznia do lutego 2021 r. Pod koniec lutego 2021 r. Operacja Warp Speed została przekazana w zakres obowiązków Zespołu Reagowania na COVID-19 Białego Domu .
Program promował masową produkcję wielu szczepionek i różnych rodzajów technologii szczepionek, w oparciu o wstępne dowody, umożliwiając szybszą dystrybucję, jeśli badania kliniczne potwierdzą, że jedna ze szczepionek jest bezpieczna i skuteczna. [ Potrzebne źródło ] W planie przewidziano, że niektóre z tych szczepionek nie okażą się bezpieczne ani skuteczne, przez co program będzie bardziej kosztowny niż opracowanie typowej szczepionki, ale potencjalnie doprowadzi do dostępności skutecznej szczepionki kilka miesięcy wcześniej niż typowe ramy czasowe.
Operacja Warp Speed, początkowo finansowana kwotą około 10 miliardów dolarów z ustawy CARES (Coronavirus Aid, Relief and Economic Security) uchwalonej przez Kongres Stanów Zjednoczonych 27 marca 2020 r., była programem międzyagencyjnym obejmującym elementy Departamentu Zdrowia i Usługi , w tym Centra Kontroli i Zapobiegania Chorobom , Administracja Żywności i Leków , Narodowe Instytuty Zdrowia oraz Urząd ds. Zaawansowanych Badań i Rozwoju Biomedycznych (BARDA); Departament Obrony ; firmy prywatne; oraz inne agencje federalne, w tym Departament Rolnictwa , Departament Energii i Departament Spraw Weteranów .ODZYSKIWANIE Próba
W marcu 2020 r. w Wielkiej Brytanii rozpoczęto szeroko zakrojone, randomizowane badanie kontrolowane o nazwie RECOVERY Trial w celu przetestowania możliwych metod leczenia COVID-19. Jest prowadzony przez Nuffield Departments of Public Health and of Medicine na Uniwersytecie Oksfordzkim i testuje pięć leków o zmienionym przeznaczeniu, a także osocze rekonwalescentów . Do czerwca 2020 r. w Wielkiej Brytanii w badaniu wzięło udział ponad 11 500 uczestników z pozytywnym wynikiem na COVID-19.
W kwietniu brytyjskie badanie RECOVERY (Randomised Evaluation of COVid-19 theRAPY) rozpoczęło się początkowo w 132 szpitalach w całej Wielkiej Brytanii, stając się jednym z największych na świecie badań klinicznych dotyczących COVID-19, obejmującym 5400 zakażonych osób leczonych w 165 brytyjskich szpitalach , od połowy kwietnia. W badaniu badane są różne potencjalne terapie ciężkiego zakażenia COVID-19: lopinawir/rytonawir, deksametazon w małej dawce ( steroid przeciwzapalny ), hydroksychlorochina i azytromycyna (powszechny antybiotyk ). W czerwcu przerwano grupę badawczą stosującą hydroksychlorochinę, gdy analizy wykazały, że nie przyniosła ona żadnych korzyści.
16 czerwca grupa badawcza wydała oświadczenie, że wykazano, że deksametazon zmniejsza śmiertelność u pacjentów otrzymujących wspomaganie oddychania. W kontrolowanym badaniu około 2000 pacjentów szpitalnych otrzymało deksametazon i porównano je z ponad 4000 pacjentów, którzy nie otrzymywali tego leku. W przypadku pacjentów podłączonych do respiratorów zmniejszyło to ryzyko śmierci z 40% do 28% (1 na 8). W przypadku pacjentów potrzebujących tlenu zmniejsza ryzyko śmierci z 25% do 20% (1 na 5).
Do końca czerwca 2020 r. w badaniu opublikowano wyniki dotyczące hydroksychlorochiny i deksametazonu . Ogłosił również wyniki dla lopinawiru / rytonawiru , które zostały opublikowane w październiku 2020 r. Ramiona lopinawiru-rytonawiru i hydroksychlorochiny zostały zamknięte dla nowych uczestników po tym, jak wykazano, że są nieskuteczne. Deksametazon został zamknięty dla nowych zgłoszeń dorosłych po pozytywnych wynikach, a do listopada 2020 r. Był otwarty dla zgłoszeń dzieci.
Próba PANORAMICZNA
Rozpoczęte w grudniu 2021 r. badanie PANORAMIC przetestuje skuteczność molnupirawiru i nirmatrelwiru/rytonawiru w zapobieganiu hospitalizacji i pomaganiu w szybszym powrocie do zdrowia osobom w wieku powyżej 50 lat oraz osobom o podwyższonym ryzyku ze względu na choroby współistniejące. PANORAMIC jest sponsorowany przez Uniwersytet Oksfordzki i finansowany przez National Institute for Health Research (NIHR). Od marca 2022 r. zarejestrowanych jest ponad 16 000 osób, co czyni je największym badaniem dotyczącym leków przeciwwirusowych na COVID-19.
Zobacz też
Dalsza lektura
- Kaplon H, Reichert JM (2021). „Przeciwciała do obejrzenia w 2021 roku” . mAb . 13 (1): 1860476. doi : 10.1080/19420862.2020.1860476 . PMC 7833761 . PMID 33459118 .
- McCreary EK, Pogue JM (kwiecień 2020). „Leczenie choroby koronawirusowej 2019: przegląd wczesnych i pojawiających się opcji” . Otwarte forum Choroby zakaźne . 7 (4): z aa105. doi : 10.1093/ofid/ofaa105 . PMC 7144823 . PMID 32284951 .
- Tuccori M, Ferraro S, Convertino I, Cappello E, Valdiserra G, Blandizzi C, et al. (2020). „Przeciwciała monoklonalne neutralizujące anty-SARS-CoV-2: rurociąg kliniczny” . mAb . 12 (1): 1854149. doi : 10.1080/19420862.2020.1854149 . PMC 7755170 . PMID 33319649 .
- Yang L, Liu W, Yu X, Wu M, Reichert JM, Ho M (lipiec 2020). „Narzędzie do śledzenia terapii przeciwciałami COVID-19: globalna internetowa baza danych leków opartych na przeciwciałach do zapobiegania i leczenia COVID-19” . Antib Ther . 3 (3): 205–12. doi : 10.1093/abt/tbaa020 . PMC 7454247 . PMID 33215063 .