Ikotynib
 | |
| Dane kliniczne | |
|---|---|
| Nazwy handlowe | Conmana |
| Inne nazwy | BPI-2009H |
Drogi podawania |
Tabletki doustnie |
| Kod ATC | |
| Dane farmakokinetyczne | |
| Biodostępność | 52% |
| Metabolizm | Wątroba (głównie CYP3A4 , mniej CYP1A2 ) |
| Okres półtrwania w fazie eliminacji | 5,5 godziny ( mediana ) |
| Wydalanie | >98% w postaci metabolitów, z czego >90% z kałem , 9% z moczem |
| Identyfikatory | |
| Numer CAS |
|
| Identyfikator klienta PubChem | |
| IUPHAR/BPS | |
| ChemSpider | |
| UNII |
|
| KEGG | |
| CHEMBL | |
| Pulpit nawigacyjny CompTox ( EPA ) | |
| Dane chemiczne i fizyczne | |
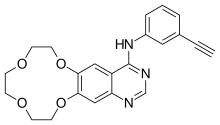
| Formuła | C22H21N3O4 _ _ _ _ _ _ _ |
| Masa cząsteczkowa | 391,427 g · mol -1 |
| Model 3D ( JSmol ) | |
| |
| |
Ikotynib (nazwa handlowa Conmana ) jest wysoce selektywnym inhibitorem kinazy tyrozynowej receptora naskórkowego czynnika wzrostu pierwszej generacji (EGFR-TKI). Ikotynib jest dopuszczony do stosowania w Chinach jako monoterapia pierwszego rzutu u pacjentów z niedrobnokomórkowym rakiem płuca z somatycznymi mutacjami EGFR.
Rozwój
Ikotynib został po raz pierwszy zsyntetyzowany w 2002 roku przez firmę Betta Pharma. Amerykańskie zgłoszenie patentowe dotyczące preparatu ikotynibu i chlorowodorku ikotynibu zostało złożone 28 grudnia 2012 r., a przyznane 21 lipca 2015 r.
Mechanizm akcji
Ikotynib jest pochodną chinazoliny , która kompetycyjnie hamuje miejsce wiązania ATP białka receptora EGFR . EGFR napędza złośliwy wzrost komórek , gdy występują mutacje w domenie kinazy tyrozynowej tego białka. Takie mutacje powodują niekontrolowaną proliferację komórek, która niewłaściwie aktywuje antyapoptotyczny szlak sygnałowy Ras . Blokując wiązanie ATP z EGFR, ikotynib zapobiega aktywności kaskady transdukcji sygnału, która inicjuje mitozę .
Wskazania
Ikotynib jest zarejestrowany w Chinach do leczenia niedrobnokomórkowego raka płuca u pacjentów z mutacją EGFR, u których choroba jest zaawansowana lub z przerzutami.
Badania kliniczne
Badanie ICOGEN było bezpośrednim badaniem III fazy z podwójnie ślepą próbą, porównującym ikotynib z gefitynibem u 399 pacjentów w 27 ośrodkach w Chinach. Wyniki wykazały, że ikotynib ma medianę przeżycia wolnego od progresji choroby wynoszącą 4,6 miesiąca (95% CI 3,5 – 6,3) w porównaniu z gefitynibem , dla którego PFS wynosi 3,4 miesiąca (95% CI 2,3 – 3,8). Analiza post-hoc wykazała mniej zdarzeń niepożądanych podczas stosowania ikotynibu niż gefitynibu (odpowiednio 61% i 70%, p = 0,046).
Badanie ISAFE było badaniem IV fazy oceniającym bezpieczeństwo i toksyczność ikotynibu u 5549 pacjentów. Wykazał ogólny wskaźnik zdarzeń niepożądanych na poziomie 31,5% i wskaźnik odpowiedzi na lek na poziomie 30%.
Po uzyskaniu zgody FDA na badanie ikotynibu u pacjentów z NSCLC, zaplanowano przeprowadzenie badania fazy 1 w Roswell Park Comprehensive Cancer Center w stanie Nowy Jork , jednak badanie zostało wycofane przed włączeniem do badania. Od tego czasu nie pojawiły się żadne dalsze badania nad ikotynibem w USA.
Zatwierdzenia regulacyjne
Ikotynib został zatwierdzony w Chinach przez SFDA w czerwcu 2011 r. Wskazanie do stosowania ikotynibu zostało zatwierdzone w Chinach przez SFDA w listopadzie 2014 r. jako leczenie pierwszego rzutu u pacjentów z zaawansowanym stadium NSCLC z mutacją EGFR.