3,4-Metylenodioksyamfetamina
 | |
 | |
| Dane kliniczne | |
|---|---|
Drogi podawania |
Doustnie, podjęzykowo, wdmuchiwanie, dożylnie |
| Kod ATC |
|
| Status prawny | |
| Status prawny |
|
| Dane farmakokinetyczne | |
| Metabolizm | Wątroba ( w dużym stopniu zaangażowany CYP ) |
| Wydalanie | Nerkowy |
| Identyfikatory | |
| |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| Bank Leków | |
| ChemSpider | |
| UNII | |
| CHEMBL | |
| Pulpit nawigacyjny CompTox ( EPA ) | |
| Karta informacyjna ECHA | 100.230.706 |
| Dane chemiczne i fizyczne | |
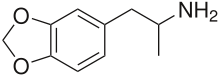
| Formuła | C10H13NO2 _ _ _ _ _ _ |
| Masa cząsteczkowa | 179,219 g·mol -1 |
| Model 3D ( JSmol ) | |
| |
| |
|
| |
3,4-metylenodioksyamfetamina (znana również jako MDA i sass ) jest empatogenem-entaktogenem , psychostymulantem i psychodelicznym lekiem z rodziny amfetamin , który jest spotykany głównie jako narkotyk rekreacyjny . Z punktu widzenia farmakologii MDA działa przede wszystkim jako środek uwalniający serotoninę-norepinefrynę-dopaminę (SNDRA). W większości krajów narkotyk jest substancją kontrolowaną , a jej posiadanie i sprzedaż są kontrolowane są nielegalne.
MDA jest rzadko poszukiwany jako narkotyk rekreacyjny w porównaniu z innymi narkotykami z rodziny amfetamin; pozostaje jednak ważnym i szeroko stosowanym lekiem, ponieważ jest głównym metabolitem, produktem wątrobowej N-dealkilacji MDMA ( ecstasy). Ponadto często stwierdza się, że MDA zafałszowuje nielegalnie produkowane MDMA.
Używa
Medyczny
MDA nie ma obecnie akceptowanego zastosowania medycznego.
rekreacyjny
MDA jest kupowane, sprzedawane i używane jako rekreacyjny „narkotyk miłosny” ze względu na poprawę nastroju i empatii . Czasami podaje się, że dawka rekreacyjna MDA wynosi od 100 do 160 mg.
Niekorzystne skutki
MDA wywołuje serotonergiczne działanie neurotoksyczne, które uważa się za aktywowane przez początkowy metabolizm MDA. Ponadto MDA aktywuje odpowiedź neurogleju , chociaż ta ustępuje po użyciu.
Przedawkować
Objawy ostrej toksyczności mogą obejmować pobudzenie , pocenie się , podwyższone ciśnienie krwi i tętno , dramatyczny wzrost temperatury ciała , drgawki i śmierć . Śmierć jest zwykle spowodowana zaburzeniami pracy serca i późniejszym krwotokiem mózgowym ( udar ). [ wymagany cytat medyczny ]
Farmakologia
Farmakodynamika
MDA jest substratem transporterów serotoniny , noradrenaliny , dopaminy i pęcherzykowych monoamin , a także agonistą TAAR1 i z tych powodów działa jako inhibitor wychwytu zwrotnego i środek uwalniający serotoninę , norepinefrynę i dopaminę (czyli jest SNDRA ). Jest także agonistą serotoniny 5-HT 2A , 5-HT 2B i 5-HT 2C receptorów oraz wykazuje powinowactwo do α 2C adrenergicznych α 2A , α 2B i oraz HT 7 receptorów serotoniny 5 -HT 1A i 5 - .
Izomer optyczny ( S ) MDA jest silniejszy niż izomer optyczny ( R ) jako środek psychostymulujący, wykazując większe powinowactwo do trzech transporterów monoamin .
Jeśli chodzi o subiektywne i behawioralne efekty MDA, uważa się, że uwalnianie serotoniny jest wymagane do jego działania empatogennego-entaktogennego, uwalnianie dopaminy i norepinefryny jest odpowiedzialne za jego działanie psychostymulujące, uwalnianie dopaminy jest niezbędne do jego euforycznego ( nagradzającego i uzależniającego ) efekty psychodeliczne, a bezpośredni agonizm receptora serotoninowego 5-HT 2A jest przyczyną jego efektów psychedelicznych. [ wymagany cytat medyczny ]
Farmakokinetyka
Czas trwania leku został zgłoszony jako około 6 do 8 godzin.
Chemia
MDA to podstawiona metylenodioksylowana fenyloetyloamina i pochodna amfetaminy . W stosunku do innych fenyloetyloamin i amfetamin jest to 3,4-metylenodioksy, α-metylowa pochodna β-fenyloetyloaminy , 3,4-metylenodioksy pochodna amfetaminy oraz N - demetylowa pochodna MDMA.
Synonimy
Oprócz 3,4-metylenodioksyamfetaminy , MDA jest również znany pod innymi chemicznymi synonimami, takimi jak:
- α-Metylo-3,4-metylenodioksy-β-fenyloetyloamina
- 1-(3,4-metylenodioksyfenylo)-2-propanoamina
- 1-(1,3-benzodioksol-5-ilo)-2-propanoamina
Synteza
MDA jest zwykle syntetyzowany z olejków eterycznych, takich jak safrol lub piperonal . Typowe podejścia z tych prekursorów obejmują:
- alkenowej grupy funkcyjnej safrolu z kwasem mineralnym zawierającym halogen , a następnie alkilowanie aminy .
- Utlenianie Wackera safrolu z wytworzeniem 3,4-metylenodioksyfenylopropan-2-onu (MDP2P), a następnie redukcyjne aminowanie lub redukcja jego oksymu .
- Reakcja Henry'ego piperonalu z nitroetanem , a następnie redukcja związków nitrowych .
- Reakcję Darzensa na heliotropinę przeprowadzili również J. Elks i in. Daje to MDP2P , który następnie poddano reakcji Leuckarta.
Wykrywanie w płynach ustrojowych
MDA można oznaczać ilościowo we krwi, osoczu lub moczu w celu monitorowania użycia, potwierdzenia diagnozy zatrucia lub pomocy w dochodzeniu kryminalistycznym w sprawie ruchu drogowego lub innego przestępstwa lub nagłej śmierci. Niektóre programy badań przesiewowych pod kątem nadużywania narkotyków opierają się na próbkach włosów, śliny lub potu. Większość komercyjnych testów przesiewowych na obecność amfetaminy wykazuje znaczną reakcję krzyżową z MDA i głównymi metabolitami MDMA, ale techniki chromatograficzne pozwalają łatwo rozróżnić i oddzielnie zmierzyć każdą z tych substancji. Stężenia MDA we krwi lub moczu osoby, która przyjmowała tylko MDMA, są na ogół mniejsze niż 10% stężenia leku macierzystego.
Pochodne
MDA stanowi część struktury rdzenia protokylolu , agonisty receptora β-adrenergicznego .
Historia
MDA został po raz pierwszy zsyntetyzowany przez C. Mannicha i W. Jacobsohna w 1910 roku. Po raz pierwszy został spożyty w lipcu 1930 roku przez Gordona Allesa , który później udzielił licencji na lek firmie Smith, Kline & French . MDA po raz pierwszy zastosowano w testach na zwierzętach w 1939 r., a próby na ludziach rozpoczęto w 1941 r. w celu zbadania możliwych terapii choroby Parkinsona . W latach 1949-1957 ponad 500 ludzi otrzymało MDA w celu zbadania jego potencjalnego zastosowania jako środka przeciwdepresyjnego i/lub anorektycznego przez Smith, Kline i francuski . Armia Stanów Zjednoczonych również eksperymentowała z lekiem o nazwie kodowej EA-1298, pracując nad opracowaniem leku prawdy lub środka obezwładniającego. Harold Blauer zmarł w styczniu 1953 roku po dożylnym wstrzyknięciu, bez jego wiedzy i zgody, 450 mg leku w ramach Projektu MKUltra . MDA został opatentowany jako środek ataraktyczny przez Smitha, Kline'a i Frencha w 1960 r., a jako środek anorektyczny pod nazwą handlową „Amphedoxamine” w 1961 r. MDA zaczął pojawiać się na narkotyków rekreacyjnych około 1963-1964. Była wtedy niedroga i łatwo dostępna jako substancja chemiczna do badań z kilku naukowych dostawców. Kilku badaczy, w tym Claudio Naranjo i Richard Yensen, zbadało MDA w dziedzinie psychoterapii .
Społeczeństwo i kultura
Nazwa
Kiedy MDA był w fazie rozwoju jako potencjalny lek farmaceutyczny, nadano mu międzynarodową niezastrzeżoną nazwę (INN) tenamfetaminy .
Status prawny
Australia
MDA jest substancją zabronioną z wykazu 9 w ramach norm dotyczących trucizn . Substancja z wykazu 9 jest wymieniona jako „Substancje, które mogą być nadużywane lub używane niezgodnie z przeznaczeniem, których wytwarzanie, posiadanie, sprzedaż lub używanie powinno być prawnie zabronione, z wyjątkiem przypadków, gdy są wymagane do badań medycznych lub naukowych lub do celów analitycznych, dydaktycznych lub szkoleniowych z aprobata władz Wspólnoty Narodów i/lub stanowych lub terytorialnych organów ds. zdrowia”.
Stany Zjednoczone
MDA jest substancją kontrolowaną z Wykazu I w USA.
Badania
W 2010 roku zbadano zdolność MDA do wywoływania mistycznych doświadczeń i zmiany widzenia u zdrowych ochotników. Badanie wykazało, że MDA jest „potencjalnym narzędziem do badania doświadczeń mistycznych i percepcji wzrokowej”.
Linki zewnętrzne
- agoniści 5-HT2A
- agoniści 5-HT2B
- agoniści 5-HT2C
- Benzodioksole
- Leki, którym nie przypisano kodu ATC
- Entaktogeny i empatogeny
- Euforanty
- Leki psychodeliczne
- Środki uwalniające serotoninę-norepinefrynę-dopaminę
- Agoniści receptora serotoninowego
- stymulanty
- Podstawione amfetaminy
- agoniści TAAR1
- Inhibitory VMAT

